Polymerace: jak polymery jsou vyrobeny
spojení dlouhé řetězce molekul je známý jako polymerizace.
abychom věci udrželi jednoduché, podívejme se na jeden druh polymerace zvaný „adiční polymerace“. Kromě polymerace – uhodli jste-se monomery jednoduše sčítají v opakujícím se vzoru. To vede k tomu, že se nevytvoří žádná jiná, další látka.
(jiný způsob, jakým lze polymery vytvářet, se nazývá kondenzační polymerace., V tomto procesu, když je každý monomer přidán do řetězce, je jako vedlejší produkt vytvořena další malá molekula—například voda. Nylon a polyester jsou vyrobeny tímto způsobem.)
přídavná polymerace se opírá o monomer s dvojnou vazbou spojující dva atomy uhlíku. Je zavedena molekula nazývaná volný radikál, která způsobuje, že se dvojitá vazba otevře a spojí se s další molekulou monomeru. Polymerní řetězec se vytváří, když se stejná základní jednotka opakuje znovu a znovu v pravidelné řetězové struktuře., Zatímco použití volných radikálů tímto způsobem není nový nápad, chemici pravidelně objevují molekuly, které jsou mnohem účinnější při výrobě polymerů. To znamená, že polymery mohou být vyrobeny rychleji, levněji, čistěji a s větší kontrolou konečného produktu.
pojďme se přiblížit a podívat se na tento proces trochu podrobněji, jako příklad použijte tvorbu polyethylenu.
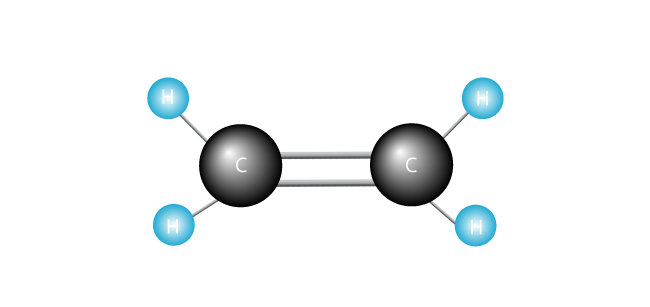
polyethylen je nejjednodušší syntetický polymer. Skládá se z jednoho druhu monomeru-ethylenu, který je vyroben ze dvou atomů uhlíku a dvou atomů vodíku., (Jiné polymery mohou být vyrobeny ze dvou nebo více různých monomerů.) Polyetylén vzniká, když jsou spojeny tisíce ethylenových molekul od konce do konce.
proces začíná zahříváním molekuly, jako je peroxid vodíku.
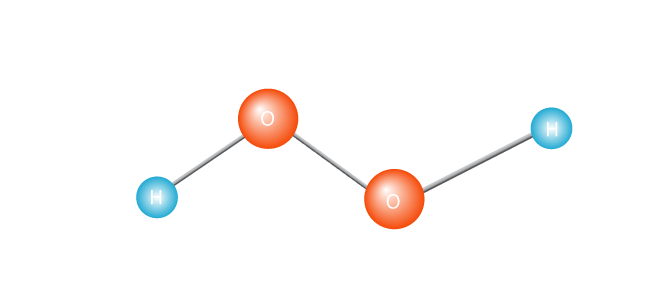
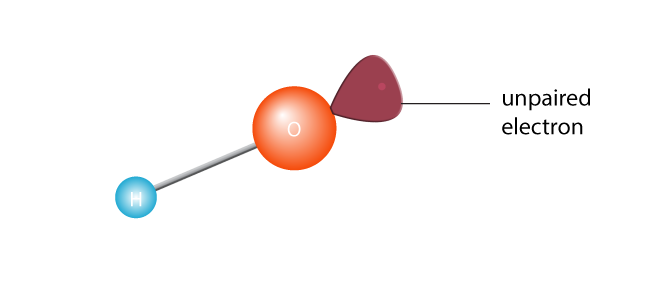
to způsobí, že se štěpí ve dvou a vytvoří volný radikál. Volný radikál je molekula s jediným nepárovým elektronem. Elektrony jsou extroverty atomového světa; opravdu se nedokážou vyrovnat s tím, že jsou sami., Nebo, chcete-li získat technické, Molekula s nepárovým elektronem ve svém nejvzdálenějším valenčním plášti je nestabilní molekula. Ať tak či onak, osamělý elektron se bude chtít spárovat s jiným elektronem.
nyní představujeme naši molekulu ethylenu.
volný radikál hledá další elektron, s nimiž se dvojice jeho osamělý jeden elektron.,
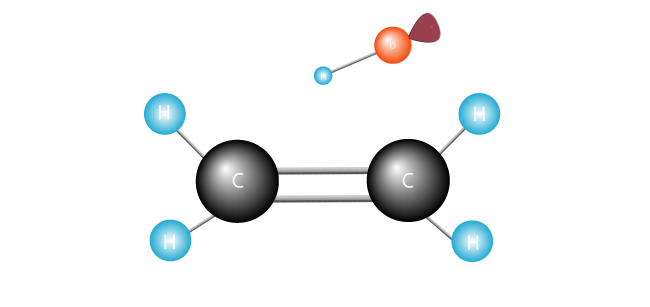
napadá dvojnou vazbu spojující dva uhlíky v ethylen molekula a ohání elektron.
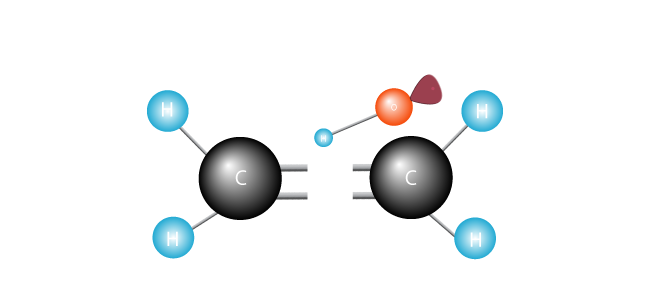
jeho elektrony šťastně spárovány, volný radikál spojuje jeden z uhlíků.
druhý uhlík, dříve šťastně spárovaný, má nyní nepárový elektron. To se stalo volného radikálu, nepárový elektron touží se spojit s jinou, aby se pár.,
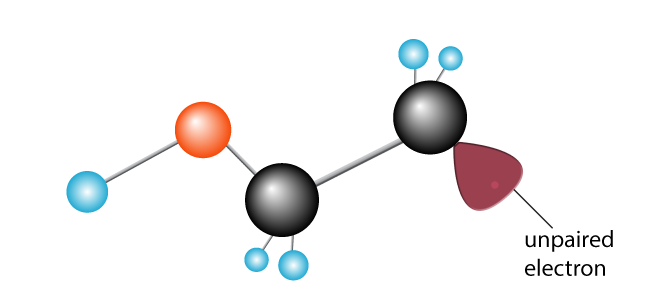
je zavedena druhá molekula ethylenu. Nově vzniklý volný radikál přestávky uhlík-uhlík, bít elektron a vytváří nový volný radikál s jeden nepárový elektron na konci.
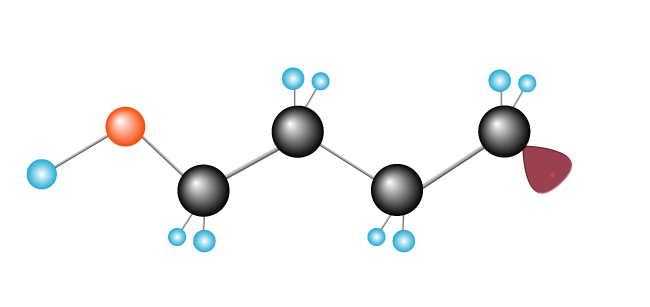
Tady pokračuje, jako řetězovou reakci, s dlouhým řetězcem, které tvoří jak více ethylenu molekuly jsou přidány.,
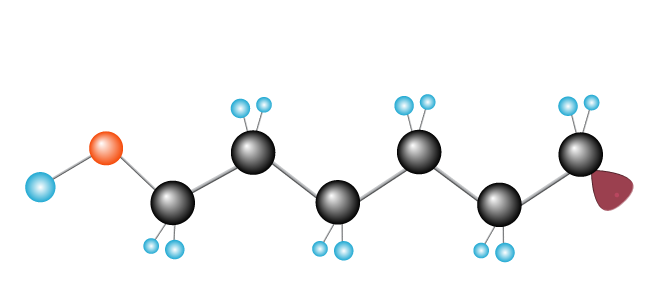
tento proces pokračuje, dokud volné radikály splňuje další volný radikál, dokončení řetězce.
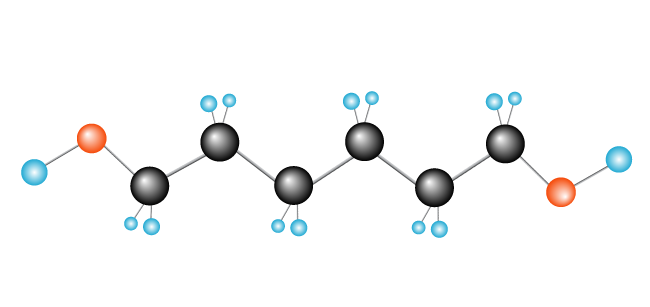
Nyní máme polymer, polyethylenu, vyrobený z monomeru (opakování unit) ethylenu.,
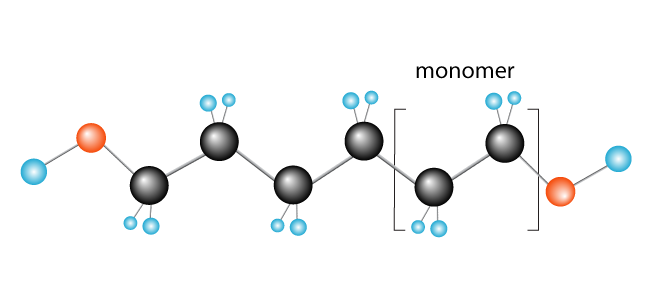
Některé další příklady polymerů vytvořených tímto způsobem jsou polychloroethylene (PVC), který se používá, aby se věci, jako instalatérské trubky a izolace pro elektrické kabely, a polypropylenu, který se používá v produkty, jako jsou gumové kachny (a další hračky) a, pokud jsou zpracovávány do vláken koberce.















