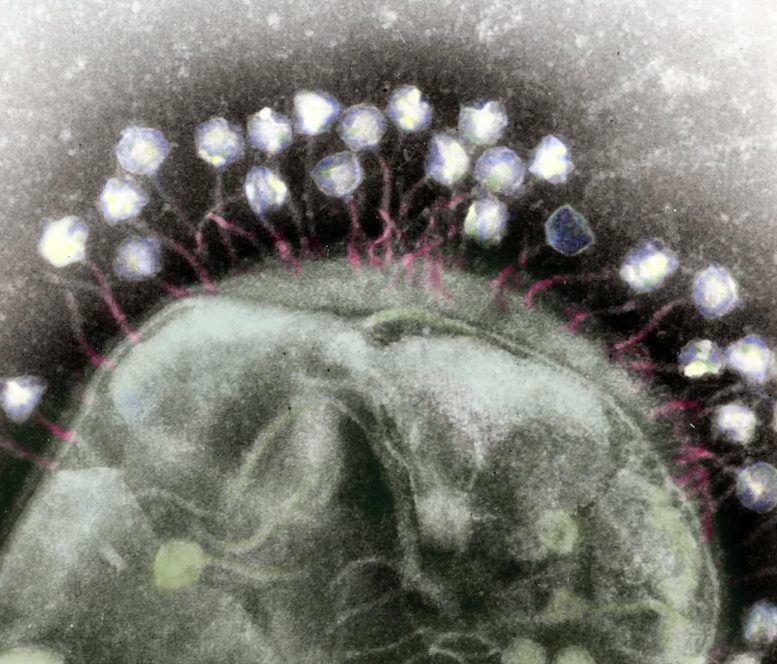
false-barva transmisní elektronové mikrofotografie více bakteriofágy připojen k bakteriální buněčné stěny. Kredit: Wikimedia Commons,
nový genetický přístup může urychlit studium phage-mikrob interakce s důsledky pro zdraví, zemědělství a klimatu.
Vědci jsou neustále hledají nové a lepší způsoby, jak se vypořádat s bakteriemi, bude to odstranit nemoc-působit kmeny nebo upravit potenciálně prospěšné kmeny., A to i přes četné chytré drogy a genetické inženýrství nástroje, které lidé vymysleli pro tyto úkoly, tyto přístupy se může zdát neohrabaný, když ve srovnání s jemně vyladěné útoky vedené bakteriofágy – viry, které infikují bakterie.
Fágů, stejně jako ostatní paraziti se neustále vyvíjejí způsoby, jak cílit a využívat jejich specifických hostitele bakteriální kmen, a na druhé straně, bakterie se neustále vyvíjí znamená vyhnout fágů., Tyto věčné bitvy o přežití přinášejí neuvěřitelně rozmanité molekulární arzenály, které vědci chtějí studovat, přesto to může být únavné a náročné na práci.
Chcete-li získat přehled o těchto obranných strategiích, tým vedený vědci z laboratoře Berkeley právě vyvinul efektivní a levnou novou metodu. Jak bylo uvedeno v PLOS Biology, tým ukázal, že kombinací tří technik lze odhalit, které bakteriální receptory fágů využívají infikovat buňku, stejně jako to, co buněčné mechanismy bakterie použít k reakci na fágové infekce.,
„i Přes téměř století molekulární práce, základní mechanismy fág-hostitelské interakce jsou známy jen pro několik párů, kde host je dobře-studoval model organismu, které mohou být kultivovány v laboratoři,“ řekl odpovídající autor Vivek Mutalik, výzkumné vědce v Berkeley Laboratoře Environmentální Genomiky a systémové Biologie (EGSB) Divize. „Fágy však představují nejhojnější biologické entity na Zemi a díky jejich vlivu na bakterie jsou klíčovými hybateli environmentálních cyklů živin, zemědělské produkce a zdraví lidí a zvířat., To se stalo nutností získat více foundational znalosti těchto interakcí, s cílem lépe porozumět planety microbiomes a vyvinout nové léky, jako jsou bakterie na bázi očkovacích látek nebo fágových koktejly k léčbě infekce rezistentní na antibiotika.“
Zářící světlo na „temné hmoty“
tým je tři-pronged přístup, tzv. čárovým kódem, ztráta-of-funkce a gain-of-function knihovny, používá zavedená technika vytváření genových delecí a také zvýšení genové exprese identifikovat geny, které bakterie používají se vyhnout fágů., Tato informace také říká vědcům, na které receptory se fágy zaměřují, aniž by museli analyzovat genomy fágů. (Vědci však plánují v budoucnu přizpůsobit techniku pro použití na virech, dozvědět se ještě více o jejich funkci.)
Mutalik a jeho kolegové testovali svou metodu na dvou kmenech E. coli, o nichž je známo, že jsou zaměřeny na 14 geneticky rozmanitých fágů., Jejich výsledky potvrdily, že metoda funguje hladce tím, že rychle odhalí stejné suite fágové receptory, které byly dříve identifikovány přes desítky let výzkumu, a také za předpokladu, nové hity, které byly minul v dřívějších studiích.
umělecké Vykreslování fágů. Kredit: Antara Mutalik
podle Mutalika lze přístup také zmenšit-až současně vyhodnotit fágové vztahy pro stovky bakterií odebraných z různých prostředí., To bude pro vědce mnohem snazší studovat biologickou „temnou hmotu planety“, která se týká nekultivovatelných, a proto špatně pochopených mikroorganismů, které oplývají v mnoha prostředích. Ve skutečnosti se odhaduje, že 99% všech živých mikroorganismů nemůže být kultivováno v laboratoři.
tým přístup také představuje příležitost ke standardizaci genetické zdroje použité v phage výzkumu, který byl vždy ad-hoc a vysoce variabilní proces, a vytvořit dělitelný činidla a datových souborů.,
„role fágů je obrovská „známá-neznámá“, protože víme, že všude jsou fágy, ale sotva víme nic víc. Například chápeme méně než 10% genů kódovaných v dříve sekvenovaných genomech fágů,“ řekl Mutalik. „Nyní, když konečně máme zjednodušený nástroj pro pohled na fágy, existuje mnoho vzrušujících otázek, na které můžeme začít odpovídat, a příležitost změnit svět.,“
Tato práce byla v čele Mutalik a kolegy EGSB vědci Adam Arkin a Adam Deutschbauer v Berkeley Lab, ve spolupráci s vědci na univerzitě v Berkeley a Evergreen State College. Výzkum byl financován Mikrobiologie program Inovativní Genomics Institute a ENIGMA, Vědecké Zaměření Části programu pod vedením Berkeley Lab, a je podporován DOE Office of Science.















