stavební kameny bílkovin jsou aminokyseliny, které jsou malé organické molekuly, které se skládají z alfa (centrálního) atomu uhlíku spojeny s aminoskupiny, karboxylové skupiny, atomu vodíku, a variabilní složkou tzv. vedlejší řetězce (viz níže). V proteinu je více aminokyselin spojeno peptidovými vazbami, čímž vzniká dlouhý řetězec., Peptidové vazby jsou tvořeny biochemickou reakcí, která extrahuje molekulu vody, protože spojuje aminoskupinu jedné aminokyseliny s karboxylovou skupinou sousední aminokyseliny. Lineární sekvence aminokyselin v proteinu je považována za primární strukturu proteinu.
proteiny jsou postaveny ze sady pouze dvaceti aminokyselin, z nichž každá má jedinečný postranní řetězec. Boční řetězce aminokyselin mají různé chemie. Největší skupina aminokyselin má nepolární postranní řetězce., Několik dalších aminokyselin má postranní řetězce s pozitivními nebo negativními náboji, zatímco jiné mají polární, ale nezmapované boční řetězce. Chemie postranních řetězců aminokyselin je rozhodující pro strukturu bílkovin, protože tyto postranní řetězce se mohou navzájem spojit, aby udržely délku proteinu v určitém tvaru nebo konformaci. Nabité aminokyselinové postranní řetězce mohou tvořit iontové vazby a polární aminokyseliny jsou schopné vytvářet vodíkové vazby. Hydrofobní boční řetězce vzájemně interagují prostřednictvím slabých van der Waalsových interakcí. Převážná většina vazeb tvořených těmito postranními řetězci je nekovalentní., Ve skutečnosti jsou cysteiny jedinými aminokyselinami schopnými vytvářet kovalentní vazby, které dělají se svými konkrétními postranními řetězci. Vzhledem k interakcím postranního řetězce vede sekvence a umístění aminokyselin v konkrétním proteinu, kde se v tomto proteinu vyskytují ohyby a záhyby (Obrázek 1).,
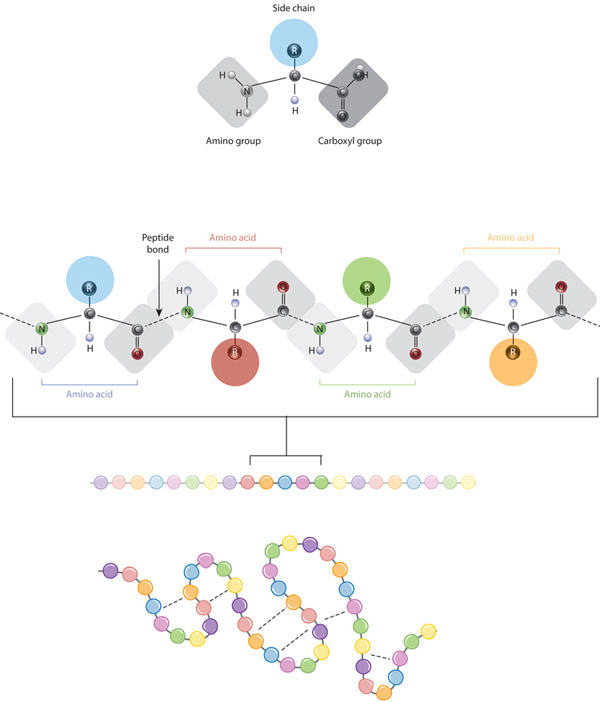
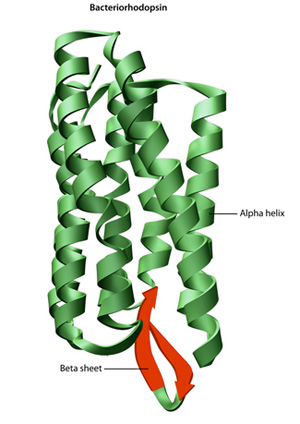
primární strukturu bílkoviny — aminokyselinová sekvence — drives skládací a intramolekulární lepení lineární aminokyselinový řetězec, což v konečném důsledku určuje protein je jedinečný trojrozměrný tvar. Vodíkové vazby mezi aminoskupiny a karboxylové skupiny v sousedních oblastech proteinového řetězce někdy způsobuje určité vzory skládací dojít., Známý jako alfa-šroubovice a beta listy, tyto stabilní skládací vzory tvoří sekundární strukturu proteinu. Většina proteinů obsahuje více helixů a listů, kromě jiných méně běžných vzorů (Obrázek 2). Soubor formací a záhybů v jediném lineárním řetězci aminokyselin — někdy nazývaném polypeptid — tvoří terciární strukturu proteinu. Konečně, kvartérní struktura proteinu se týká těch makromolekul s více polypeptidovými řetězci nebo podjednotkami.,
konečný tvar nově syntetizovaného proteinu je obvykle energeticky nejpříznivější. Jak se proteiny skládají, testují různé konformace před dosažením jejich konečné formy, která je jedinečná a kompaktní. Složené proteiny jsou stabilizovány tisíci nekovalentních vazeb mezi aminokyselinami. Kromě toho chemické síly mezi proteinem a jeho bezprostředním prostředím přispívají k tvaru a stabilitě bílkovin., Například proteiny, které jsou rozpuštěny v buněčné cytoplazmě, mají na svých površích hydrofilní (vodě milující) chemické skupiny, zatímco jejich hydrofobní (voda-averzní) prvky mají tendenci být zastrčeny uvnitř. V kontrastu, proteiny, které jsou vloženy do buněčné membrány zobrazit některé hydrofobní chemických skupin na jejich povrchu, zejména v těch regionech, kde protein povrch je vystaven membránových lipidů. Je však důležité si uvědomit, že plně složené bílkoviny nejsou zmrazeny do tvaru. Spíše atomy uvnitř těchto proteinů zůstávají schopné provádět malé pohyby.,
přestože jsou proteiny považovány za makromolekuly, jsou příliš malé na vizualizaci, a to i mikroskopem. Vědci tedy musí použít nepřímé metody, aby zjistili, jak vypadají a jak jsou složeni. Nejběžnější metodou používanou ke studiu proteinových struktur je rentgenová krystalografie. Při této metodě jsou pevné krystaly vyčištěného proteinu umístěny v rentgenovém paprsku a vzor vychýlených rentgenových paprsků se používá k předpovědi polohy tisíců atomů v proteinovém krystalu.















