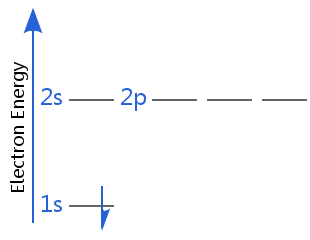el estado fundamental de un núcleo atómico, átomo o molécula es su estado de energía más bajo.Los estados de energía superior se describen como estados excitados.

el estado fundamental se aplica a cualquier propiedad cuantizada de a particle.In química,
* estados básicos de electrones
• estados básicos vibracionales
• estados básicos rotacionales
de átomos y moléculas son importantes, al igual que sus estados excitados.,
a temperatura ambiente, la mayoría de las moléculas se encuentran en Estados básicos de electrones y vibraciones; se necesitan temperaturas más altas para que las moléculas entren en estados excitados.Sin embargo, la mayoría de las moléculas están en un estado de rotación excitado a temperatura ambiente, porque se necesita menos energía para que una molécula entre en un estado de excitación rotacional que un electrón o un estado de excitación vibracional.
Electron Ground States
Los diagramas de abajo muestran los niveles de energía de electrones para un hidrógeno atom.In el primer diagrama, el hidrógeno está en su estado fundamental de electrones.,
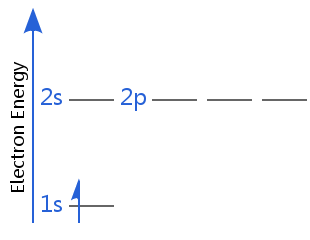
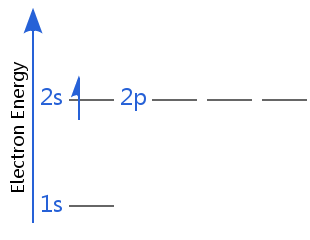
En el segundo diagrama, el hidrógeno, el electrón se encuentra en una energía superior shell: el hidrógeno no está en su electrónica del estado fundamental; está en un estado excitado.(Recuerde que el hidrógeno, con un electrón, tiene subcapas degeneradas, por lo que 2s es degenerado con 2p – en todos los demás átomos, los electrones en la subcapa 2p tienen mayor energía que en los 2s.
si el electrón de hidrógeno gana más energía podría entrar en subniveles más altos como 3s, 3p, 4s, 3d, etc. En todos estos casos, estaría en un estado excitado.,
volviendo al estado fundamental
Las partículas en estados excitados pueden regresar al estado fundamental liberando energía.La energía se pierde en forma de radiación electromagnética.
- cuando los electrones en átomos o moléculas emiten energía y caen en subniveles de energía más bajos, incluso en el estado fundamental, la energía toma la forma de luz visible o ultravioleta.
- La energía vibratoria se pierde por la emisión de luz infrarroja.
- La energía rotacional se pierde por la emisión de microondas o radiación infrarroja lejana.,
Estados fundamentales degenerados
Si hay más de un estado fundamental, significa que hay más de un estado de energía más baja.
por ejemplo, los diagramas a continuación muestran dos Estados tierra de energía iguales para hydrogen.In uno, el espín del electrón es+½; en el otro es -½.