Los bloques de construcción de las proteínas son aminoácidos, que son pequeñas moléculas orgánicas que consisten en un átomo de carbono alfa (central) vinculado a un grupo amino, un grupo carboxilo, un átomo de hidrógeno y un componente variable llamado cadena lateral (ver más abajo). Dentro de una proteína, múltiples aminoácidos están unidos entre sí por enlaces peptídicos, formando así una cadena larga., Los enlaces peptídicos se forman por una reacción bioquímica que extrae una molécula de agua a medida que se une al grupo amino de un aminoácido al grupo carboxilo de un aminoácido vecino. La secuencia lineal de aminoácidos en una proteína se considera la estructura primaria de la proteína.
Las proteínas se construyen a partir de un conjunto de solo veinte aminoácidos, cada uno de los cuales tiene una cadena lateral única. Las cadenas laterales de los aminoácidos tienen diferentes químicas. El grupo más grande de aminoácidos tiene cadenas laterales no polares., Varios otros aminoácidos tienen cadenas laterales con cargas positivas o negativas, mientras que otros tienen cadenas laterales polares pero sin carga. La química de las cadenas laterales de aminoácidos es crítica para la estructura de la proteína porque estas cadenas laterales pueden unirse entre sí para mantener una longitud de proteína en una cierta forma o conformación. Las cadenas laterales cargadas de aminoácidos pueden formar enlaces iónicos, y los aminoácidos polares son capaces de formar enlaces de hidrógeno. Las cadenas laterales hidrofóbicas interactúan entre sí a través de interacciones débiles de van der Waals. La gran mayoría de los enlaces formados por estas cadenas laterales no son covalentes., De hecho, las cisteínas son los únicos aminoácidos capaces de formar enlaces covalentes, lo que hacen con sus cadenas laterales particulares. Debido a las interacciones de la cadena lateral, la secuencia y la ubicación de los aminoácidos en una proteína en particular guían donde las curvas y pliegues ocurren en esa proteína (Figura 1).,
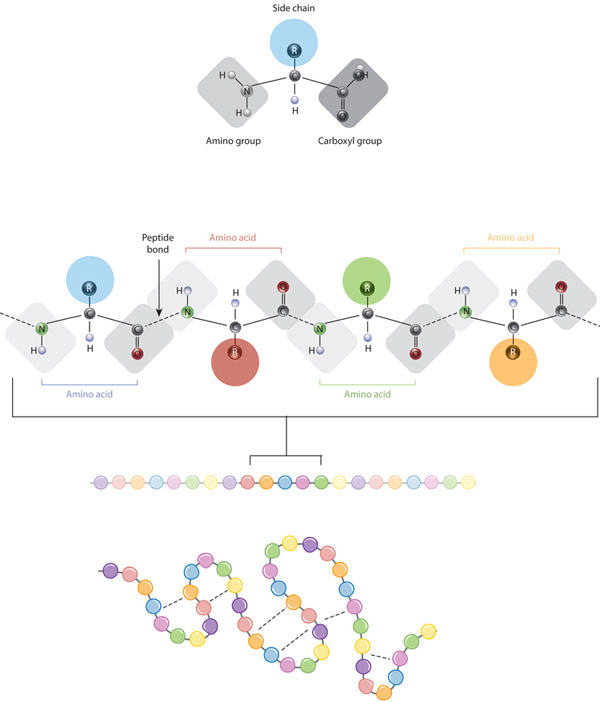
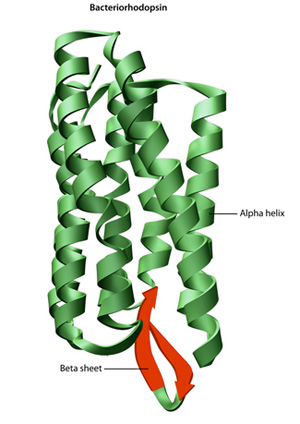
La estructura primaria de una proteína de su secuencia de aminoácidos — unidades el plegamiento y intramolecular de la vinculación de los lineales de aminoácidos de cadena, que en última instancia determina la proteína de la única forma tridimensional. El enlace de hidrógeno entre grupos amino y grupos carboxilo en regiones vecinas de la cadena de proteínas a veces causa ciertos patrones de plegamiento., Conocidos como hélices alfa y hojas beta, estos patrones de plegado estables constituyen la estructura secundaria de una proteína. La mayoría de las proteínas contienen múltiples hélices y hojas, además de otros patrones menos comunes (Figura 2). El conjunto de formaciones y pliegues en una sola cadena lineal de aminoácidos — a veces llamado polipéptido — constituye la estructura terciaria de una proteína. Finalmente, la estructura cuaternaria de una proteína se refiere a aquellas macromoléculas con múltiples cadenas o subunidades polipeptídicas.,
la forma final adoptada por una proteína recién sintetizada es típicamente la más energéticamente favorable. A medida que las proteínas se pliegan, prueban una variedad de conformaciones antes de alcanzar su forma final, que es única y compacta. Las proteínas plegadas son estabilizadas por miles de enlaces no covalentes entre aminoácidos. Además, las fuerzas químicas entre una proteína y su entorno inmediato contribuyen a la forma y estabilidad de la proteína., Por ejemplo, las proteínas que se disuelven en el citoplasma celular tienen grupos químicos hidrofílicos (amantes del agua) en sus superficies, mientras que sus elementos hidrofóbicos (reacios al agua) tienden a estar escondidos dentro. En contraste, las proteínas que se insertan en las membranas celulares muestran algunos grupos químicos hidrofóbicos en su superficie, específicamente en aquellas regiones donde la superficie de la proteína está expuesta a los lípidos de la membrana. Es importante tener en cuenta, sin embargo, que las proteínas completamente plegadas no se congelan en forma. Más bien, los átomos dentro de estas proteínas siguen siendo capaces de hacer pequeños movimientos.,
aunque las proteínas se consideran macromoléculas, son demasiado pequeñas para visualizarlas, incluso con un microscopio. Por lo tanto, los científicos deben usar métodos indirectos para averiguar cómo se ven y cómo se doblan. El método más común utilizado para estudiar las estructuras proteicas es la cristalografía de rayos X. Con este método, los cristales sólidos de proteína purificada se colocan en un haz de rayos X, y el patrón de rayos X desviados se utiliza para predecir las posiciones de los miles de átomos dentro del cristal de proteína.















