propiedades químicas de fenolftaleína, Usos, Producción
indicador ácido–base
la fenolftaleína es otro ácido orgánico débil. No es particularmente soluble en agua, por lo que generalmente lo disolveremos en etanol acuoso. El etanol explica el olor agradable y dulce de las soluciones de fenolftaleína.
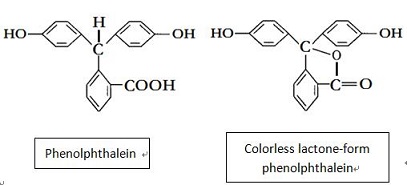
la fenolftaleína es incolora y clara en soluciones ácidas, pero imparte un color rosa intenso en soluciones alcalinas de pH más alto, con λ(max) = 552 nm., La forma coloreada de la fenolftaleína contiene una fracción de quinona; de hecho, cualquier cromóforo basado en una quinona tiene un color rojo. Pero si se prepara una solución a pH 7 (por ejemplo, determinado con un medidor de pH), encontramos que el indicador de fenolftaleína sigue siendo incoloro, y el color rosa solo aparece cuando el pH alcanza 8,2. Por lo tanto, tenemos un problema: el indicador no ha detectado neutralidad, ya que cambia de color a un valor demasiado alto de pH. de hecho, solo se necesita una pequeña adición incremental de solución alcalina para aumentar sustancialmente el pH de la solución en varias unidades de pH., En otras palabras, una fracción de una gota de solución alcalina es la única diferencia entre el pH 7 (en el volumen real en la neutralización) y el pH 8 cuando la fenolftaleína cambia de incolora a Rosa puce.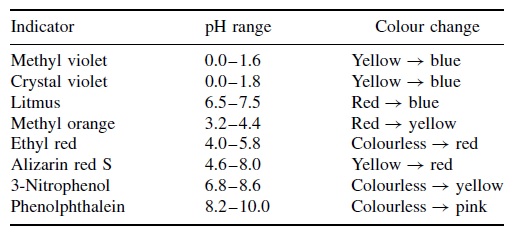
La Figura 1 enumera los cambios de pH para una serie de indicadores comunes de pH. Los cambios de color se producen en un amplio rango de pHs, el valor exacto depende del indicador elegido. El violeta de metilo cambia de amarillo a azul a medida que el pH aumenta entre 0 y 1.6. En el extremo opuesto, la fenolftaleína responde a los cambios de pH en el rango de 8,2 a 10.,
propiedades químicas
la fenolftaleína es un ácido orgánico débil, a temperatura ambiente, que aparece como pequeños cristales amarillos blancos o microstrip, sin olor, insípido, insoluble en agua y soluble en alcohol (etanol) y éter. Cuando se disuelve en solución de alcohol, puede estar hecho de ácido y álcali indicador. Es incoloro en solución ácida mientras exhibe color rojo en la solución de carbonato de metal alcalino. Sin embargo, si se coloca en la solución alcalina concentrada, producirá sal Tri-metal incolora para que el color rojo se desvanezca., En vista de esta característica, el laboratorio lo usa comúnmente como un tipo de indicador de titulación de ácido y álcali con el rango de decoloración del PH alrededor de 8.2 a 10.0, girando de incoloro a rojo. Cuando el reactivo de fenolftaleína se deja caer en agua o solución acuosa ácida neutra, habrá turbidez blanca. Esto se debe a que el alcohol es fácilmente soluble en agua, por lo que el reactivo fenolftaleína insoluble en agua se precipita., Las otras aplicaciones principales son las siguientes:
1, Las materias primas farmacéuticas en la industria farmacéutica: es adecuado para el estreñimiento persistente habitual, incluyendo tabletas, supositorios y otras formulaciones.
2, se puede utilizar para la síntesis orgánica: se utiliza principalmente en la síntesis de plásticos, especialmente en la síntesis de la ftalazinona poli aril éter cetona poli aril éter cetona polímeros., Este tipo de polímeros, debido a su excelente resistencia al calor, resistencia al agua, resistencia a la corrosión, resistencia al envejecimiento por calor y buena procesabilidad, fibras, recubrimientos y compuestos hechos de él son ampliamente utilizados en los campos de equipos eléctricos y electrónicos, transporte y Aeroespacial, Ingeniería de Energía Atómica y militar.
3, utilizado como indicador del ácido y del álcali, indicador no acuoso de la titulación de la solución y reactivos del análisis de la cromatografía.,
Descripción general
la fenolftaleína actúa principalmente sobre el intestino grueso, que produce excretas semilíquidas en 4 a 8 horas con poco o ningún cólico. La afirmación de que la fenolftaleína amarilla es tres veces más fuerte que el blanco sigue sin probarse. Como resultado de la circulación enterohepática, el efecto de una sola dosis es sostenible durante 3 a 4 días. El medicamento es un miembro activo de muchos laxantes que se pueden vender legalmente sin receta.
efectos adversos graves son raros, pero pueden ocurrir cuando se utiliza en exceso., La fenolftaleína debe evitarse en los ancianos, ya que su papel a largo plazo puede causar un agotamiento severo del agua y los electrolitos. Dermatitis (erupción fija, picazón, sensación de ardor, ampollas y pigmentación residual) puede ocurrir en pacientes alérgicos. Se notificaron casos de anafilaxia mortal, pero no hubo relación causal definitiva con la fenolftaleína. Hay informes ocasionales de púrpura no trombocitopénica. La administración de larga duración puede causar ocasionalmente deshidratación y desequilibrio electrolítico debido a la diarrea excesiva. La fenolftaleína causa orina alcalina o heces de color rosa.,
estructura molecular de fenolftaleína
este producto se puede obtener mezclando anhídrido ftálico con fenol, seguido de co-calentamiento con ácido sulfúrico.
la fenolftaleína tiene su nombre químico ser ácido 2 – benzoico. Fórmula Molecular: C20H16O4, masa molecular relativa: 318.33. La fórmula estructural se muestra en la Figura 1 (de hecho, a menudo existe en forma de lactona incolora, ver Figura 2). Aparece como polvo cristalino triclínico blanco a amarillento con el punto de fusión de 237 ~ 259 ℃ y la densidad relativa de 1.277 (20/4 ℃)., Es fácilmente soluble en etanol, éter y otros disolventes orgánicos, ligeramente soluble en agua. Tiene una acidez débil y se presenta casi por completo en el estado molecular incluso en solución muy diluida. Es soluble en solución alcalina, exhibiendo color rojo en solución alcalina, pero es incoloro en solución ácida. Los tres anillos de benceno en la molécula de fenolftaleína están vinculados a los átomos de carbono de un centro híbrido sp3, y no hay relación conjugada entre los anillos de benceno, siendo incoloros., Después de cruzar el álcali, el anillo de lactona se abre y genera sal disódica, los átomos de carbono centrales se transfieren al estado híbrido sp2, que contiene la estructura de benzoquinona. En este momento, forma un sistema conjugado con los tres anillos de benceno que son rojos; pero en exceso de álcali, pero se convierte aún más al estado híbrido sp3 para que el sistema conjugado desaparezca, el color también retrocederá.
indicador de fenolftaleína
El indicador de fenolftaleína es un indicador de titulación de ácido/álcali comúnmente utilizado en Química Analítica., La fenolftaleína, en solución alcalina, tiene su anillo de lactona incolora abierto para formar la estructura de quinona con el color que exhibe el rojo. Al encontrarse con un álcali fuerte, la fenolftaleína se puede convertir en carboxilato incoloro. Su gama de colores es pH 7.0 (incoloro) ~ 10.0 (rojo). La solución de prueba se preparó disolviendo 1 g de etanol al 90% por litro de etanol.
la fenolftaleína es incolora en la solución de pH por debajo de 8.5, se vuelve roja a un pH superior a 9., Sobre la cantidad excesiva de álcali y ningún color, el proceso del color es como sigue: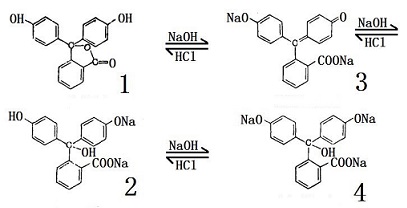 la fenolftaleína, cuando está utilizada como indicador ácido-álcali de la titulación, se utiliza generalmente en una concentración de la concentración del 1%. 1 g de fenolftaleína se disolvió en 100 ml de alcohol al 80%; lentamente caer 0,1 mol / l hidróxido de sodio a rojizo (para neutralizar la pequeña cantidad de ácido potencialmente existente en el alcohol). El rango de pH de la decoloración es de 8.2 a 10. Es incoloro en PH < 8.2, es Rojo en pH> 10., El principio del cambio de color se debe principalmente a que bajo diferentes condiciones de ácido y álcali, la estructura de la molécula en sí cambia y causa más colores diferentes. Mezclar la fenolftaleína y otros indicadores puede formular el indicador ampliamente utilizado (también conocido como un indicador general).mezclar 1,3 gramos de fenolftaleína, 0,9 gramos de azul de bromo-timol, 0,4 gramos de rojo de metilo y 0,2 gramos de azul de timol y disolver en 1 litro 70% a 80% de alcohol. Después de disolver completamente, luego agregue un poco de hidróxido de sodio de 0.1 mol / l hace que se vuelva verde antes de la aplicación., La ventaja es que el cambio de color con los cambios de pH es notable: rojo para pH = 4; naranja para pH 5; amarillo para pH 6, Verde para pH 7; Cian para pH 8; Azul para pH 9; y púrpura para pH 10.
la fenolftaleína, cuando está utilizada como indicador ácido-álcali de la titulación, se utiliza generalmente en una concentración de la concentración del 1%. 1 g de fenolftaleína se disolvió en 100 ml de alcohol al 80%; lentamente caer 0,1 mol / l hidróxido de sodio a rojizo (para neutralizar la pequeña cantidad de ácido potencialmente existente en el alcohol). El rango de pH de la decoloración es de 8.2 a 10. Es incoloro en PH < 8.2, es Rojo en pH> 10., El principio del cambio de color se debe principalmente a que bajo diferentes condiciones de ácido y álcali, la estructura de la molécula en sí cambia y causa más colores diferentes. Mezclar la fenolftaleína y otros indicadores puede formular el indicador ampliamente utilizado (también conocido como un indicador general).mezclar 1,3 gramos de fenolftaleína, 0,9 gramos de azul de bromo-timol, 0,4 gramos de rojo de metilo y 0,2 gramos de azul de timol y disolver en 1 litro 70% a 80% de alcohol. Después de disolver completamente, luego agregue un poco de hidróxido de sodio de 0.1 mol / l hace que se vuelva verde antes de la aplicación., La ventaja es que el cambio de color con los cambios de pH es notable: rojo para pH = 4; naranja para pH 5; amarillo para pH 6, Verde para pH 7; Cian para pH 8; Azul para pH 9; y púrpura para pH 10.
Se pueden formular diferentes indicadores amplios según sea necesario. Indicador de fenolftaleína no solo se utiliza en laboratorios, sino también ampliamente utilizado en la producción industrial y agrícola., Además de ser utilizado en el control de pH de la reacción y análisis de valoración de ácido/álcali durante la fabricación de productos químicos, también se utiliza para determinar el pH del tejido en la industria de impresión y teñido. Esto es muy importante para el procesamiento de impresión y teñido. Por ejemplo, si el paño mercerizado contiene álcali residual que no se ha lavado, el teñido no tendrá brillo. Sin embargo, el indicador de fenolftaleína solo puede determinar si la textura del tejido es ácida o alcalina y su rango de pH, y no puede determinar aún más su pH específico., La amplia gama de indicadores utilizados anteriormente puede reflejarse claramente de la resistencia a los ácidos y álcalis en la tela. La fenolftaleína, en medicina, también se puede usar como laxante, ya que puede estimular el peristaltismo intestinal para promover la defecación. Sin embargo, ocasionalmente puede causar reacciones alérgicas como dermatitis, por lo que debe usarse con atención.
papel de prueba de fenolftaleína
el papel de prueba de fenolftaleína es uno de los papeles de prueba simples comúnmente utilizados en el análisis químico. Es altamente objetivo. Se vuelve rojo en caso de álcali, y es incoloro en solución ácida y neutra., Para probar la presencia de amoníaco en el aire, aparecerá un rojo claro. El método de preparación es simple: el papel de filtro se sumerge en una solución de fenolftaleína y se saca para secarse después de la absorción completa.
Farmacología y Toxicología
la fenolftaleína se puede utilizar para el tratamiento del estreñimiento refractario habitual, actuando principalmente sobre el colon. Después de la administración oral, se puede descomponer lentamente bajo el efecto del líquido alcalino del intestino delgado para formar sal sódica soluble, estimulando así el plexo dentro de la pared intestinal., Actúa directamente sobre el músculo liso intestinal y aumenta el peristaltismo, al tiempo que inhibe la absorción de agua dentro del intestino, de modo que el agua y el electrolito se acumulan en el colon, lo que resulta en efecto laxante. Tiene un efecto leve y rara vez causa calambres intestinales.
farmacocinética
aproximadamente el 15% se absorbe después de la administración oral., Los medicamentos absorbidos existen principalmente en forma de glucurónido para ser excretado de la orina o las heces, algunos también pueden ser excretados al intestino a través de la bilis, reabsorbidos en el intestino, para formar la circulación intestinal – hepática y prolongar el tiempo de papel. A las 4 a 8 horas después de la administración del medicamento, los pacientes descargarán heces blandas. El tiempo de excreción para la administración del medicamento una vez necesita 3 a 4 días. Este producto también se puede secretar de la leche.,
reacciones adversas
la fenolftaleína tiene efecto principalmente en el intestino grueso, lo que lleva a la formación de poca cantidad de heces semilíquidas en 4 a 8 horas sin cólicos. No se ha demostrado la afirmación de que la fenolftaleína amarilla es tres veces más fuerte que la versión blanca. Como resultado de la circulación enterohepática, el efecto de una sola dosis puede durar de 3 a 4 días. Este medicamento es un miembro activo en una gran cantidad de preparaciones laxantes que pueden venderse legalmente sin receta médica.
Los efectos adversos graves son raros,pero pueden ocurrir en exceso., Para los ancianos, la fenolftaleína debe colgarse, ya que su efecto duradero puede causar un agotamiento grave del agua y los electrolitos. En pacientes alérgicos, puede causar dermatitis (erupción fija, picazón, sensación de ardor, ampollas y pigmentación residual). Hay informes de reacciones alérgicas mortales, pero aún no se ha determinado que estén relacionadas con la fenolftaleína. Hay informes ocasionales de púrpura no trombocitopénica y la aparición de deshidratación y desequilibrio electrolítico causó diarrea excesiva después de la aplicación a largo plazo., La fenolftaleína hace que la orina alcalina o las heces se vuelvan rosadas.
aplicación
este producto es un indicador ácido de uso común con el rango de cambio de color entre pH 8.2 (incoloro) a 10.0 (rojo). La fenolftaleína también es un medicamento, se puede usar como laxante, actuando sobre el colon para el tratamiento del estreñimiento.utilizado como indicador ácido-base; como laxante irritante para el tratamiento del estreñimiento
método de producción
se deriva de la condensación de anhídrido ftálico y fenol.,
propiedades químicas
polvo de cristal blanco a amarillo claro
usos
antihelmíntico
usos
utilizado como indicador para valoraciones acidimétricas.
definición
un indicador ácido-base que es soluciones ácidas sin color y se vuelve rojo si el pH se eleva por encima del rango de Transición de8–9.6. Se utiliza como indicador en titulaciones para las que el punto final se encuentra claramente en el lado básico (pH>7), por ejemplo, ácido oxálico o hidrogentartrato potásico contra causticsoda.
definición
fenolftaleína: colorante utilizado como indicador de base anácida., Tiene un pH inferior a 8 y un rojo superior a 9,6. Se utiliza en titulaciones que involucran débiles ácidos y bases fuertes. También se utiliza como laxante.,Bold laxine;Bom-bon;Bon-bon;Canisan;Certolax;D & m tablets;Darmol;Euchessinia;Evac-qwik tablets;Evactil;Feen-a-mint;Fractines vichy;Fractine-vichy;Fructines-vichy;Kalimalterin;Kest;Kondremul with phenolphtalein;Laxante yer;Laxatabs;Laxatone;Laxen busto;Minilax;Modane plus;Mucinum;Musilaks;Neoprunex;Neopurghes;Novopuren;Paradeines;Peplax;Petrolaglar emulsion;Petro-mul-phen;Phillips laxcaps;Prifunal;Prunetta;Pugrante el aleman;Purganol;Purganos-daguin;Purgant aleman;Purgante orravan;Purgenum;Purgestol;Purgoids;Purgyl;Purjen sahap;Sarolax;Thalinol mrt;Unisvelt;Veracolate.,
Organización Mundial de la Salud (OMS)
la fenolftaleína se ha utilizado ampliamente como laxante desde que su actividad patártica se describió por primera vez en 1902. Debido a que sufre enterohepaticacirculación se elimina lentamente y se ha asociado con efectos adversos,especialmente reacciones cutáneas, pérdida de potasio y atonía. Esto ha llevado a la retirada de fenolftaleína de los preparados farmacéuticos en varios países.En otros lugares, sigue estando disponible, a menudo en preparaciones de venta libre.
perfil de seguridad
carcinógeno confirmado., La administración de alimentos y Medicamentos de los Estados Unidos recomienda la eliminación de las formulaciones laxantes. Moderadamente tóxico por vía intraperitoneal. Efectos sistémicos humanos: cambios en la composición de la orina, gastritis, náuseas o vómitos. Utilizado en medicina como laxante; en química como indicador. Cuando se calienta para descomponerse, emite humo acre y humos irritantes
carcinogenicidad
se prevé razonablemente que la fenolftaleína es un carcinógeno humano, sobre la base de pruebas suficientes de carcinogenicidad procedentes de estudios en animales de experimentación.,
Métodos de purificación
disolverlo en EtOH (7 ml / g), luego diluirlo con ocho volúmenes de agua fría, filtrar y calentar en un baño de agua para eliminar la mayor parte del alcohol y la fenolftaleína que precipita se filtra y se seca al vacío.















