Indledning
Coagulase-negative stafylokokker (CoNS) er en heterogen gruppe af stafylokokker arter, der er klassificeret klinisk ved fraværet af blod-koagulation enzym coagulase. Dette adskiller dem fra Staphylococcus aureus og nogle få klinisk mindre vigtige koagulase-positive arter., I dag er ulemper de mest almindeligt isolerede bakterier i kliniske kulturer og har vist sig som store nosokomiale patogener. Risikofaktorer for CoNS-infektion inkluderer tilstedeværelsen af indbyggede medicinske implantater, såsom intravaskulære katetre, eller immunsuppression på grund af kræftbehandling eller HIV/AIDS. Behandling af CoNS-infektioner kompliceres af fremkomsten af antibiotikaresistente stammer (såsom især MRSE, methicillinresistente S. epidermidis) (Rogers et al., 2009).,
ulemper er en integreret del af den normale flora på den menneskelige hud og slimhinder og koloniserer fortrinsvis fugtige områder (Grice et al., 2009). S. epidermidis, de mest almindelige CoNS arter genvundet fra kliniske kulturer, koloniserer armhulen, lysken, anterior nares, conjunctiva, tå weebs og perineal område (Kloos og Musselwhhite, 1975). Mens normalt uskadelige eller endda gavnlige kolonisatorer, når værtsepitelbarrieren er kompromitteret, kan ulemper som S. epidermidis forårsage alvorlige infektioner., Faktisk tegner CoNS-infektioner sig for størstedelen af bakteriel sepsis og fremmedlegeme-relaterede infektioner, hvor S. epidermidis er den mest betydningsfulde art i den henseende (Rogers et al., 2009).
værtens immunrespons på S. epidermidis, mekanismen for immuntolerance og de immunfordele, som S. epidermidis commensals kan give, er lige begyndt at blive unraveled. Denne gennemgang vil give den nyeste forskning på værtsresponsen på S. epidermidis som kommensaler og som opportunistiske bakterier i forbindelse med biofilm og septiske infektioner.,
værtens immunreaktion S. epidermidis som en Kommensale
Der er stigende dokumentation for, at huden microbiota generelt har en vigtig indvirkning på immunsystemet (Belkaid og Tamoutounour, 2016). På trods af at ulemper er blandt de vigtigste hudkolonisatorer, specifikke undersøgelser af værtens immunrespons på CoNS-kolonisering og etablering er blevet begrænset. De, der er tilgængelige, har fokuseret på immunresponset mod hudkolonisering af de prototype CoNS-arter S. epidermidis og fordelene ved en sådan kolonisering giver værten.,for eksempel har Gallo-gruppen beskrevet potentielt gavnlige funktioner af S. epidermidis som en hudkommensal. Nemlig Lai et al. rapporterede, at S. epidermidis lipoteichoic acid (LTA) gennem en mekanisme, der involverer TLR (toll-lignende receptor) 2 reducerer hudinflammation (Lai et al., 2009). De samme forfattere rapporterede også senere, at S., epidermidis (men ikke andre bakterier) giver en ikke yderligere karakteriseret stof, der er mindre end 10 kD, der aktiverer TLR2, og derved inducerer antimikrobielle peptid-produktion, hvilket har øget kapaciteten i celle lysates til at hæmme vækst af gruppe A Streptokokker og S. aureus (Lai et al., 2010) (figur 1A). Mens disse resultater understreger en gavnlig funktion af S., epidermidis på huden, om den stimulerende faktor, de har, skal ses i lyset af det faktum, at de hyppigst rapporterede aktivering af TLR2 ved LTA er blevet udfordret: LTA rensning er yderst vanskeligt og ofte indeholder TLR2-stimulerende lipopeptide forurenende stoffer, herunder i kommercielle præparater (Hashimoto et al., 2006). Disse fund kræver således bestemt yderligere vurdering ved hjælp af isogene mutanter af S. epidermidis for at verificere arten af den stimulerende faktor.
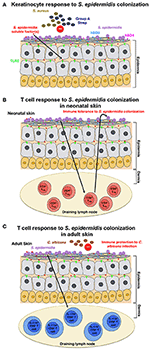
Figur 1., Model af værtens respons på S. epidermidis kolonisering (A) S. epidermidis koloniserer hudens epidermis, en stærkt organiseret struktur, der hovedsageligt består af keratinocytter. Svar til S. epidermidis kolonisering, pattern recognition receptorer (PRRs) som TLR2 på keratinocytter binde sig til dårligt karakteriseret faktor(s), der udskilles af S. epidermidis at stimulere en signalering kaskade, at resultater, for eksempel, i produktion af antimikrobielle peptider β-defensin 2 (hBD2) og hBD3. Disse antimikrobielle peptider giver beskyttelse mod kutane S. aureus og gruppe A Streptococcus infektioner., (B) S. epidermidis-kolonisering inducerer en specifik CD4+ fo .p3+ Treg-respons, hvilket er vigtigt for immuntolerance over for S. epidermidis som en kommensal. Immuntolerance antages kun at være etableret i den nyfødte periode, da kolonisering hos voksne mus ikke kunne etablere tolerance. (C) i en anden model, baseret på resultater opnået hos voksne mus, udløser hudkolonisering af S. epidermidis en specifik IL-17A+ CD8+ T-cellerespons., Primet i huden, der dræner lymfeknude af CD103 + dendritiske celler, forbedrer disse T-celler det medfødte antimikrobielle forsvar og forhindrer invasion af svampen, C. albicans.
Scharschmidt et al. viste, at kolonisering med S. epidermidis udløste en lokal såvel som systemisk, specifik CD4+ T-cellerespons som demonstreret ved berigelse af specifikke CD4+ T-celler i både de huddrenerende lymfeknuder og milten (Scharschmidt et al., 2015). Denne gruppe konstruerede S., epidermidis hudisolat, stamme t .3298, for at udtrykke peptidantigenet 2. (Epi-2.) forbundet med et fluorescerende protein. For at opnå kolonisering anvendte de 108-109 CFU ‘ er af den konstruerede Epi-2. – stamme på ryghuden af C57BL/6 mus hver 3. dag i i alt tre applikationer. Ved hjælp af denne model illustrerede forfatterne, at udvidelse af specifikt CD4+ regulatoriske T (Treg) celler spiller en kritisk rolle i immuntolerancen over for S. epidermidis., En sådan tolerance krævede imidlertid tidlig bakteriekolonisering i det nyfødte stadium, da kolonisering hos voksne mus ikke etablerede tolerance (figur 1B). Værket af Scharschmidt et al. er især spændende, da det giver den videnskabelige begrundelse for moduleringen af hudens mikrobiota i nyfødtperioden som en terapeutisk mulighed til behandling af inflammatoriske hudsygdomme, og især for atopisk dermatitis (AD).
huden hos AD-patienter koloniseres ofte af S. aureus (Higaki et al., 1999). Flere undersøgelser viser, at S., epidermidis er den næst mest almindelige mikrobe isoleret fra AD-berørte hudlæsioner (Hon et al., 2005, 2012, 2016). Selvom dette ikke direkte implicerer S. epidermidis i patogenesen af AD på grund af dets normale og hyppige overflod på huden i de seneste af disse undersøgelser, Hon et al. undersøgte bakterieisolater fra 100 AD-patienter og fandt, at S. epidermidis er til stede i de mest alvorligt AD-ramte hudlæsioner (Hon et al., 2016). Således er det tidligere foreslåede antagonistiske forhold mellem S. epidermidis og S. aureus (Cogen et al., 2010; i Iase et al.,, 2010), oversatte ikke til mindre sygdom i deres undersøgelse. Resultaterne antydede snarere, at S. epidermidis-kolonisering er forbundet med mere alvorlig AD-sygdom. Der kræves bestemt yderligere undersøgelser for at evaluere S. epidermidis rolle i AD-patogenese og arten af forholdet mellem S. aureus og S. epidermidis i AD-læsioner.
Naik et al. påvist, at S. epidermidis-kolonisering hos voksne mus inducerer en hudspecifik T-cellerespons (Naik et al., 2015). I denne undersøgelse anvendte gruppen ~5 ml 107-109 CFU pr., epidermidis over hele musens hudoverflade hver anden dag i i alt fire applikationer, en procedure, hvormed de rapporterede at opnå stabil kolonisering. De T-celler, der blev induceret i denne undersøgelse, var imidlertid IL-17A+ CD8+ T-celler snarere end CD4+ T-celler, som i Scharschmidt et al. undersøgelse (Scharschmidt et al ., 2015). Forfatterne viste, at disse IL-17A+ CD8+ T-celler givet immunitet til kutan C. albicans infektion (Figur 1C); men de har ikke undersøgt, om dette også giver immunitet til andre patogener, navnlig S. aureus (Naik et al., 2015).,
Både Scharschmidt et al. og Naik et al. undersøgelser undersøgte værten immunrespons på S. epidermidis kolonisering, men deres resultater er helt anderledes. Disse forskelle kan tilskrives nuancerne i opsætningen af musemodellerne eller muligvis også de specifikke S. epidermidis-stammer, der anvendes. På trods af forskellene i resultaterne viste de to undersøgelser kollektivt, at kolonisering med S. epidermidis inducerer et adaptivt T-cellerespons hos mus. Det er imidlertid uklart, om en sådan immunsignatur til S. epidermidis-kolonisering også observeres hos mennesker.,
immunitet mod S. epidermidis ved Biofilm-associerede infektioner
Der er udført meget få undersøgelser for at vurdere immunresponset mod CoNS biofilm-associerede infektioner, især sammenlignet med S. aureus. De fleste af disse undersøgelser har fokuseret på S. epidermidis. CoNS biofilm-associerede infektioner forekommer ofte hos patienter med medicinske implantater, hvor S. epidermidis er den mest sandsynlige art, der skal genvindes (Rogers et al., 2009)., Biofilm er komplekse, rumligt forskellige agglomerationer af bakterieceller indesluttet i en amorf, selvproduceret ekstracellulær Matri.sammensat af ekstracellulært DNA, proteiner og polysaccharider (Otto, 2008). Biofilm-associerede infektioner er ekstremt resistente over for antibiotikabehandling af flere grunde, herunder nedsat stofskifte og hæmmet penetration gennem den ekstracellulære matrix (Mah og O ‘ Toole, 2001). Derfor kræver behandling ofte kirurgisk fjernelse af den inficerede enhed eller væv., 2 milliarder dollars årligt til behandling og håndtering af ortopædiske implantatrelaterede infektioner (Darouiche, 2004; parvi .i et al., 2010).
generelt er værtsimmunresponset på en S. epidermidis biofilm-associeret infektion ikke beskyttende eller tilstrækkelig til at fjerne infektionen. Derfor er de fleste S. epidermidis biofilm-associerede infektioner kroniske. De fleste undersøgelser, der hidtil er udført om emnet, er in vitro-undersøgelser, der har sammenlignet biofilm-dyrket versus planktoniske bakterier. Resultater fra flere undersøgelser tyder på, at S., epidermidis biofilm inducerer dæmpning i fagocytisk funktion og produktion af antiinflammatoriske cytokiner sammenlignet med deres planktoniske modstykker (figur 2). Der er rapporteret modstridende fund om virkningerne af S. epidermidis biofilm på fagocytisk aktivitet. To undersøgelser rapporterede, at adhærens og fagocytose af humane neutrofiler og primære humane monocytafledte makrofager blev signifikant forbedret, når de stimuleres med biofilm-dyrkede bakterier (Hein .elmann et al., 1997; Spiliopoulou et al.,, 2012), mens andre rapporterede, at biofilmen e .opolysaccharid, polysaccharid intercellulær adhæsin (Pia) (Mack et al., 1996) spiller en væsentlig rolle i dæmpningen af fagocytisk kapacitet af murine peritoneale makrofager (Shiau og ,u, 1998), J774A.1 murine makrofager (Schommer et al., 2011), og menneskelige PMNs. Der er imidlertid enighed i litteraturen med hensyn til virkningerne af S. epidermidis biofilm på fagocytisk drab. Drab af menneskelige makrofager (Spiliopoulou et al ., 2012) og PMNs (Vuong et al., 2004; Kristian et al.,, 2008) såvel som antistofmedieret drab af leukocytter (Cerca et al., 2006) er stærkt svækket i nærvær af biofilm-dyrkede bakterier.
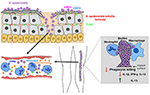
Figur 2. Model af værtens respons på S. epidermidis infektioner. Brud gennem huden kan resultere i S. epidermidis formidling i blodbanen for at forårsage bakteriæmi og akutte tilfælde af sepsis., Værtsimmunitet mod septiske infektioner afhænger i høj grad af neutrofiler, komplement samt aktivering af PRRs inklusive G-proteinkoblede receptorer (GPCR ‘ er) såsom TLR2 (grøn) og fpr2 (blå). Biofilm-associerede infektioner på medicinske implantater stammer fra forureninger under indsættelse af udstyr eller, i sjældne tilfælde, fra blodbanen. Patienter med medicinske implantater er modtagelige for S. epidermidis sepsis, da biofilmbakterier ofte kan sprede sig i blodbanen., Immunresponset på biofilm-associerede infektioner menes generelt ikke at være effektivt, da biofilm hæmmer fagocytisk drab af PMN ‘ er og makrofager. Derudover skæver de immunsystemet mod forbedret produktion af antiinflammatoriske cytokiner, såsom IL-13, mens de begrænser sekretionen af proinflammatoriske cytokiner, herunder IL1-beta, IL-12 og IFN-gamma.
komplementets rolle i CoNS biofilm-associerede infektioner er ret uklar. Mens S., epidermidis biofilm-producerende stammer fremkalder et stærkere respons i aktivering og frigivelse af komplementkomponenter end deres isogene PIA-negative og dermed biofilm-negative modstykker (Kristian et al., 2008; Fredheim et al., 2011), oversatte sådan komplementfrigivelse ikke til forbedret fagocytisk drab. S. epidermidis PIA-positive biofilm udløste C3a-frigivelse, men beskyttede S. epidermidis mod C3b og IgG-opsonisering og PMN-medieret drab (Kristian et al ., 2008)., Især-mens nogle forfattere forsøgte at tildele specifikke effekter til PIA, snarere end biofilmdannelse, ved mekanisk at ødelægge aggregater (Vuong et al., 2004), kan der i ingen af disse undersøgelser foretages en klar sondring mellem virkningerne af biofilm agglomerationer og en direkte virkning af e .opolysaccharid PIA. Hvad angår de påståede proinflammatoriske egenskaber hos Pia (Kristian et al ., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), fakta om, at PIA er et vanskeligt at rense stof og isogene PIA-negative mutanter har tydeligt forskellige celleoverfladeegenskaber, gør det vanskeligt at tildele observerede effekter direkte til Pia-molekylet.
det er rapporteret, at S. epidermidis biofilm-dyrkede stammer fremkalder produktion af antiinflammatoriske snarere end proinflammatoriske cytokiner (Spiliopoulou et al., 2012). I den respektive undersøgelse stimuleres primære humane monocytafledte makrofager med levende S., epidermidis fra 24-h biofilm produceret lavere niveauer af pro-inflammatoriske cytokiner (IL-1beta, IFN-gamma -, IL-12) og forhøjede niveauer af det anti-inflammatoriske cytokin IL-13 end planktoniske celler dyrket i 2 timer. Det er klart, i sammenligning med andre faktorer, som især quorum-sensing-reguleret pro-inflammatoriske faktorer, såsom phenol-opløselige modulins (PSMs) (Cheung et al., 2014) diskuteret nedenfor, kan gøres ansvarlig for de observerede forskelle snarere end selve biofilmdannelsen., Sammenligning af biofilm-positive med isogene biofilm-negative (Pia-negative, Embp eller Aap-negative) stammer, Schommer et al. også observeret en reduceret inflammatorisk respons i 774A. 1 makrofager med reduceret NF-kappaB aktivering og reduceret IL-1beta produktion(Schommer et al ., 2011).
lidt vides om, hvordan det adaptive immunsystem reagerer på biofilm-associerede infektioner, delvis, fordi det er vanskeligt at etablere langsigtede S. epidermidis biofilm-infektionsmodeller. Vuong et al. har udviklet en kateterrelateret Murin infektion model med en S., epidermidis bioluminescerende stamme kaldet SE SEEN43, som de var i stand til i realtid at overvåge udviklingen af S. epidermidis biofilm-associeret infektion (Vuong et al., 2008). Sammenligning af følsomheden af Nu/Nu (T-celle-mangel) og CBSCBG-MM (T/B-celle-mangel) S. epidermidis biofilm-infektion, der er forbundet med immuno-kompetente wild-type Balb/C mus, forfatterne fandt, at især Nu/Nu musene var mere modtagelige for infektion, hvilket indikerer en vigtig rolle i T-celle-medieret immunitet mod S. epidermidis biofilm-forbundet med infektion.
immunitet mod S., epidermidis under Sepsis
tilstedeværelsen af Ulemper i blodet (bakteriæmi), ofte med oprindelse fra spredning af bakterier fra en biofilm på indopereret medicinsk udstyr, der kan forårsage akut sepsis (Figur 2). CoNS bakteriæmi er forbundet med betydelige sundhedsomkostninger, sygelighed og dødelighed (Bearman og 2005en .el, 2005). Immunkompromitterede og for tidlige nyfødte er de mest sårbare over for CoNS sepsis, hvor S. epidermidis er de mest udbredte CoNS-arter involveret (Cheung og Otto, 2010).
i modsætning til S. epidermidis biofilm-associerede infektioner, som er kroniske, S., epidermidis sepsis er akut af natur. Derfor værten immunrespons på S. epidermidis sepsis, som finder sted i høj grad i blodbanen, er helt forskellig fra den mod væv-bosiddende S. epidermidis biofilm associeret-infektioner. Da nyfødte har øget modtagelighed for S. epidermidis sepsis, behandlede de fleste undersøgelser af sagen S. epidermidis neonatal sepsis. Derfor vil den følgende diskussion være fokuseret på neonatal immunitet som reaktion på S. epidermidis sepsis.,
et vigtigt element i det medfødte immunrespons er medfødte immunceller, blandt hvilke neutrofiler dominerer i antal. Neutrofiler genkender invaderende mikrober via et repertoire af værtsreceptorer (se nedenfor), indtager dem og eliminerer dem inden for fagosomet af reaktive iltarter og antimikrobielle proteiner frigivet under en proces kaldet degranulering (Malech et al., 2014). Derudover kan lyserede neutrofiler danne neutrofile ekstracellulære fælder (Net) for at binde og dræbe invaderende mikrober (Brinkmann et al., 2004).,
Flere pattern recognition receptorer (PRRs), som genkender og binder sig til bevaring mikrobielle produkter (PAMPs, pathogen-associated molecular patterns) og spiller en afgørende rolle i aktivering af det innate immunrespons, har vist sig at være kritiske i vært immunitet mod S. epidermidis sepsis. TLR2 viste sig at være kritisk for clearance af S. epidermidis i en musesepsis-model (Strunk et al., 2010). Hos humane nyfødte er der en stigning i TLR2-ekspression i løbet af S. epidermidis sepsis (viemann et al.,, 2005) blev der imidlertid rapporteret om, at et TLR-stimuleret immunsystem var mindre dygtige til at fremkalde flere cytokinresponser hos nyfødte sammenlignet med voksne (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001) og lipoteichoic acid (LTA) (2001ia et al., 2016) er blevet hævdet at være effektorer af TLR2. Undersøgelser med Pia og PSMs blev imidlertid ikke verificeret med isogene mutanter; og hvad angår LTA, har der været nylige beviser, der tyder på, at stafylokok lipopeptider snarere end LTA er de virkelige immunstimulerende midler (Hashimoto et al., 2006)., I S. aureus blev det endvidere vist, at PSMs ikke er direkte agonister af TLR2, men fører til frigivelse af lipopeptider fra celleoverfladen og således har en sekundær, TLR2-stimulerende virkning (han .elmann et al., 2016), en effekt sandsynligvis også til stede i S. epidermidis.
baseret på det faktum, at formylpeptidreceptoren 2 (fpr2) genkender PSMs (Kretschmer et al., 2010) er denne G-proteinkoblede kemoattraktantreceptor en anden potentielt vigtig værtsreceptor i responsen mod S. epidermidis. Som vist i S., aureus, PSM-FPR2 aktivering inducerer chemotaxis, granulat exocytosis, og interleukin-8 (IL-8) frigivelse fra PMNs (Wang et al., 2007; Kretschmer et al., 2010). Undersøgelser af virkningerne af PSMS of CoNS på immunresponset er kun blevet udført med rene PSMS af S. epidermidis (Cheung et al., 2010), og indtil videre er blevet hæmmet af mangfoldigheden af genetiske psm-loci i S. epidermidis og den generelle vanskelighed med at producere isogene deletionsmutanter I ulemper. Imidlertid, en nylig undersøgelse tilskrev en afgørende rolle for det mobile genetiske element-kodede, højt produceret PSM-MEC af S., epidermidis i inflammation og immun unddragelse, ved hjælp af isogene psm – mec mutanter (.in et al., 2017).
komplement spiller også en vigtig rolle i immuniteten mod S. epidermidis sepsis. Mangler i komplementfaktor C3 og IgG er forbundet med en højere risiko for neonatal CoNS-associeret sepsis (Lassiter et al., 1991). Endvidere inducerede S. epidermidis i en undersøgelse ved anvendelse af en e.-vivo fuldblods sepsis-model signifikant lavere komplementaktivering i neonatal sammenlignet med voksent blod (Granslo et al., 2013)., Denne konstatering antyder, at der er en modenhedsmangel i det neonatale komplementsystem, som til dels kan forklare, hvorfor nyfødte er mere modtagelige for S. epidermidis septiske infektioner end voksne. Desuden fremhæver denne undersøgelse vigtigheden af komplementsystemet i værtsforsvaret mod S. epidermidis sepsis.
som komplement, neutrofiler af præmative nyfødte viser modning mangel. De viser en nedsat o .idativ burst sammenlignet med dem, der er isoleret fra nyfødte, når de stimuleres med S. epidermidis (BJ .rk .vist et al., 2004)., Dette kan til dels også forklare den øgede modtagelighed hos præmative nyfødte til S. epidermidis sepsis. Interessant nok, monocytter, en anden cellulære komponent i det medfødte immunforsvar, er ikke afgørende, at værten forsvar mod neonatal S. epidermidis sepsis som både menneskelige neonatal og voksne monocytter, der vises lignende phagocytic og intracellulært drab kapacitet (Strunk et al., 2007). Samlet set indikerer dette, at neutrofiler spiller en særlig vigtig rolle i immunresponset under S. epidermidis sepsis.,
mens der er adskillige undersøgelser dedikeret til at forstå rollen som det medfødte immunrespons under S. epidermidis sepsis, forbliver forskning i rollen som det adaptive immunrespons i S. epidermidis septiske infektioner begrænset. Da disse infektioner er akutte, er det usandsynligt, at det adaptive immunrespons spiller en væsentlig rolle. Følgelig kunne intravenøs overførsel af immunoglobulin fra donorer med høje titere af antistoffer mod S. epidermidis eller S. aureus ikke beskytte mod sepsis hos præmative nyfødte (Bloom et al., 2005; DeJonge et al., 2007).,
konklusioner
CoNS infektioner og især S. epidermidis udgør en betydelig medicinsk og økonomisk byrde for den offentlige sundhedspleje. Endvidere med fremkomsten af antibiotikaresistens, behandlingsmuligheder bliver begrænset. Eliminering af S. epidermidis bakterier forekommer imidlertid uhensigtsmæssigt, da de er en integreret del af den gavnlige mikrobiota på huden og slimhinderne.
S. ‘ s gavnlige rolle, epidermidis kolonisering i forebyggelsen af patogen tilgroning på huden, baseret på resultater i mus, er blevet tilskrevet stimulering af immunresponset. Men med musens hudmodel, der næppe afspejler situationen på menneskets hud, forbliver det dårligt forstået, om resultaterne kan overføres til mennesker. Hvorvidt der er en rolle som potentiel direkte bakteriel interaktion mellem S. epidermidis og patogener på huden, skal endvidere undersøges.
immunresponset på S. epidermidis under infektion er muligvis endnu mindre godt forstået., Ved kronisk, biofilm-associeret infektion er det vanskeligt at skelne mellem virkninger af forskydningsagglomeration og dem, der medieres af specifikke celleoverfladekomponenter. Under sepsis forbliver arten og rollen af proinflammatoriske cytokiner og inflammationsveje som reaktion på S. epidermidis lige så dårligt defineret. Belysning af disse mekanismer vil også give mere information om spørgsmålet om, hvorfor nyfødte er særligt modtagelige for S. epidermidis-infektion. Fremskridt, der er gjort med hensyn til molekylærbiologiske værktøjer til S., epidermidis og ulemper generelt vil være til stor hjælp i disse bestræbelser og især hjælpe med at skelne mellem direkte og sekundære effekter. Det er klart, at en dybere forståelse af værtens immunrespons på disse infektioner vil være kritisk for udviklingen af S. epidermidis vacciner og nye terapier.
Forfatterbidrag
TN og MO skrev manuskriptet. MP og TN forberedte tal.,
Erklæring om interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
Tak
Denne undersøgelse blev støttet af Egne Research Program af National Institute of Allergy and Infectious Diseases (NIAID), det AMERIKANSKE National Institutes of Health (NIH), projekt nummer ZIA AI001080.
Kloos, E.. E., and Mussel (hite, M. S. (1975)., Fordeling og persistens af Staphylococcus og Micrococcus arter og andre aerobe bakterier på menneskers hud. Appl. Microbiol. 30, 381–385.
PubMed Abstract | Google Scholar















