Polymerisation: hvordan polymerer fremstilles
sammenføjningen af en lang kæde af molekyler kaldes polymerisation.
for at holde tingene enkle, lad os se på en slags polymerisation kaldet ‘addition polymerisation’. Desuden polymerisation – du gættede det-monomerer er simpelthen tilføjet sammen i en gentagende mønster. Dette resulterer i, at der ikke skabes noget andet, yderligere stof.
(den anden måde, hvorpå polymerer kan dannes, kaldes kondensationspolymerisation., I denne proces, når hver monomer føjes til kæden, oprettes et yderligere, lille molekyle—såsom vand—som et biprodukt. Nylon og polyester er lavet på denne måde.)
Additionspolymerisation er afhængig af en monomer med en dobbeltbinding, der forbinder to carbonatomer. Et molekyle kaldet et frit radikal introduceres, hvilket får dobbeltbindingen til at åbne op og forbinde med det næste monomermolekyle. Polymerkæden dannes, når den samme basisenhed gentages igen og igen i en almindelig kædestruktur., Mens du bruger frie radikaler på denne måde ikke er en ny id., opdager kemikere regelmæssigt molekyler, der er meget mere effektive til at fremstille polymerer. Det betyder, at polymerer kan gøres hurtigere, billigere, renere og med større kontrol over slutproduktet.
lad os zoome ind og se på denne proces lidt mere detaljeret ved hjælp af dannelsen af polyethylen som et eksempel.
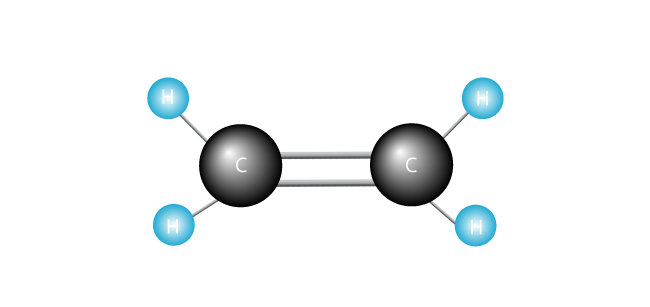
polyethylen er den enkleste syntetiske polymer. Det består af kun en slags monomer-ethylen, som er lavet af to carbonatomer og to hydrogenatomer., (Andre polymerer kan være fremstillet af to eller flere forskellige monomerer.) Polyethylen dannes, når mange tusinder af ethylenmolekyler er sammenføjet ende til ende.
processen starter med opvarmning af et molekyle, såsom hydrogenpero .id.
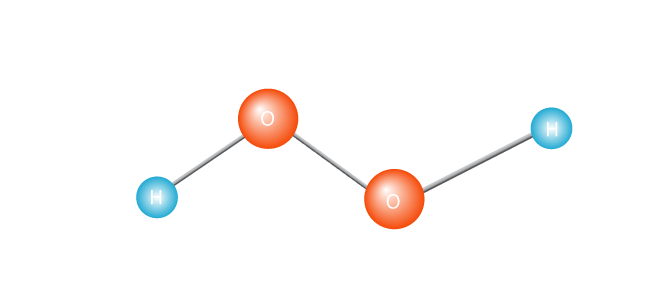
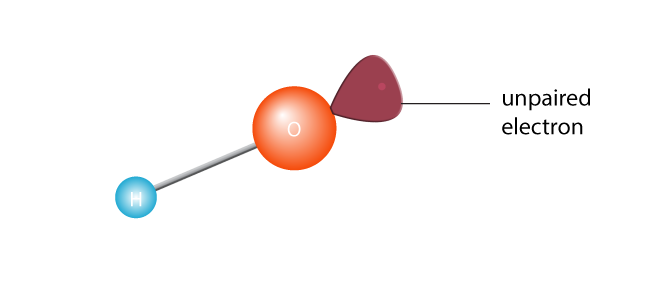
dette får det til at spalte i to, hvilket skaber et frit radikal. Et frit radikal er et molekyle med en enkelt uparret elektron. Elektroner er atomverdenens ekstroverter; de kan virkelig ikke klare at være alene., Eller for at blive teknisk er et molekyle med en uparret elektron i sin yderste valensskal et ustabilt molekyle. Uanset hvad, den ensomme elektron vil ønske at parre sig med en anden elektron.
nu introducerer vi vores ethylenmolekyle.
den frie radikal søger efter en anden elektron, som den kan parre sin ensomme enkeltelektron med.,
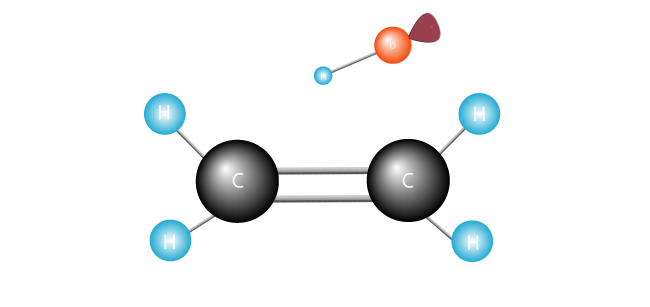
det angriber dobbeltbindingen, der forbinder de to carbonatomer i ethylenmolekylet, og stryger en elektron.
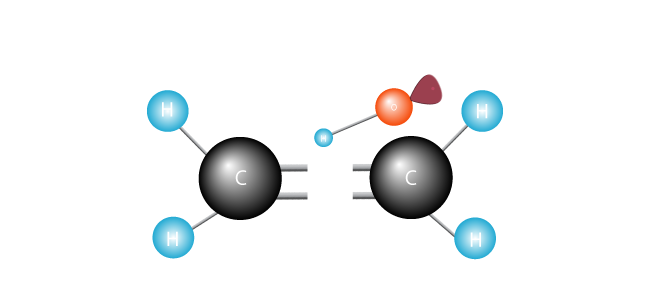
dens elektroner er lykkeligt parret, den frie radikal slutter sig til et af carbonerne.
det andet kulstof, der tidligere var lykkeligt parret, har nu en uparret elektron. Det er blevet et frit radikal, med en uparret elektron, der er ivrig efter at slutte sig sammen med en anden for at lave et par.,
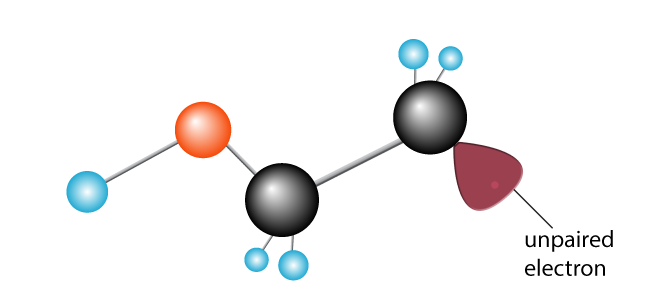
et andet ethylenmolekyle introduceres. Det nyoprettede frie radikal bryder carbon-til-carbon-bindingen, skubber en elektron og skaber et nyt frit radikal med en enkelt uparret elektron på enden.
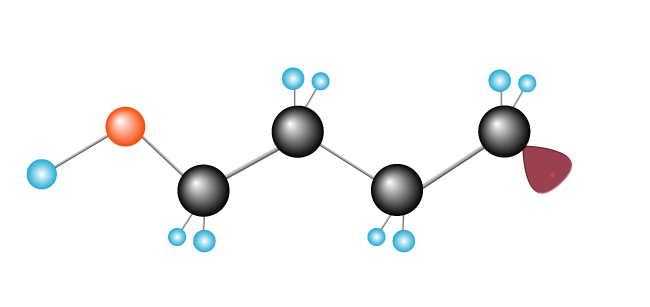
Dette fortsætter, som en kædereaktion, med en lang kæde og danner som mere ethylen-molekyler, der er tilføjet.,
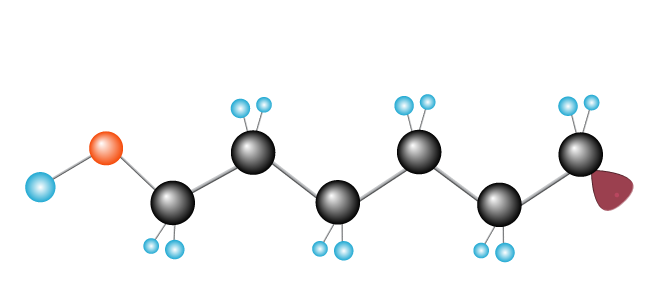
processen fortsætter, indtil frie radikaler møder et andet frit radikal, der afslutter kæden.
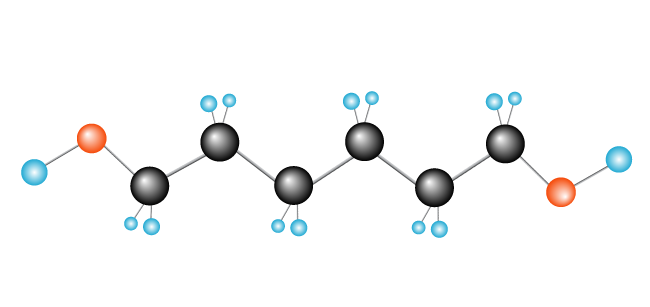
Nu har vi vores polymer, polyethylen, der består af monomer (gentaget enhed) ethylen.,
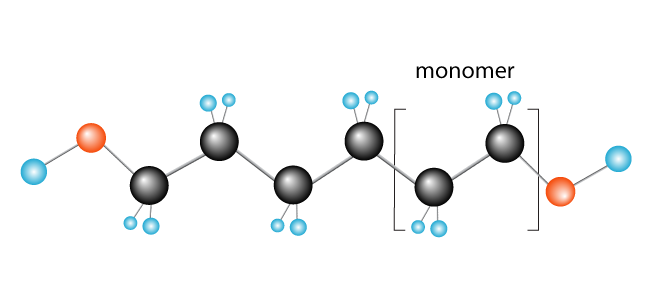
Nogle andre eksempler på polymerer, der dannes på denne måde er polychloroethylene (PVC), der anvendes til at gøre ting som vvs-rør og isolering af elektriske kabler, og polypropylen, der anvendes i produkter såsom gummi-ænder (og legetøj), og når forarbejdet til fibre, tæpper.















