byggestenene til proteiner er aminosyrer, som er små organiske molekyler, der består af et alfa (centralt) carbonatom forbundet med en aminogruppe, en Carbo .ylgruppe, et hydrogenatom og en variabel komponent kaldet en sidekæde (se nedenfor). Inden for et protein er flere aminosyrer bundet sammen af peptidbindinger, hvorved der dannes en lang kæde., Peptidbindinger dannes ved en biokemisk reaktion, der ekstraherer et vandmolekyle, når det forbinder aminogruppen af en aminosyre til Carbo .ylgruppen af en nærliggende aminosyre. Den lineære sekvens af aminosyrer i et protein betragtes som den primære struktur af proteinet.
proteiner er bygget ud fra et sæt af kun tyve aminosyrer, som hver har en unik sidekæde. Sidekæderne af aminosyrer har forskellige kemikalier. Den største gruppe af aminosyrer har ikke-polære sidekæder., Flere andre aminosyrer har sidekæder med positive eller negative ladninger, mens andre har polære, men uladede sidekæder. Kemien af aminosyresidekæder er kritisk for proteinstruktur, fordi disse sidekæder kan binde med hinanden for at holde en længde af protein i en bestemt form eller konformation. Ladede aminosyresidekæder kan danne ionbindinger, og polære aminosyrer er i stand til at danne hydrogenbindinger. Hydrofobe sidekæder interagerer med hinanden via svage van der .aals-interaktioner. Langt de fleste bindinger dannet af disse sidekæder er ikke-ovalente., Faktisk er cysteiner de eneste aminosyrer, der er i stand til at danne kovalente bindinger, som de gør med deres særlige sidekæder. På grund af sidekædeinteraktioner guider sekvensen og placeringen af aminosyrer i et bestemt protein, hvor bøjningerne og folderne forekommer i dette protein (Figur 1).,
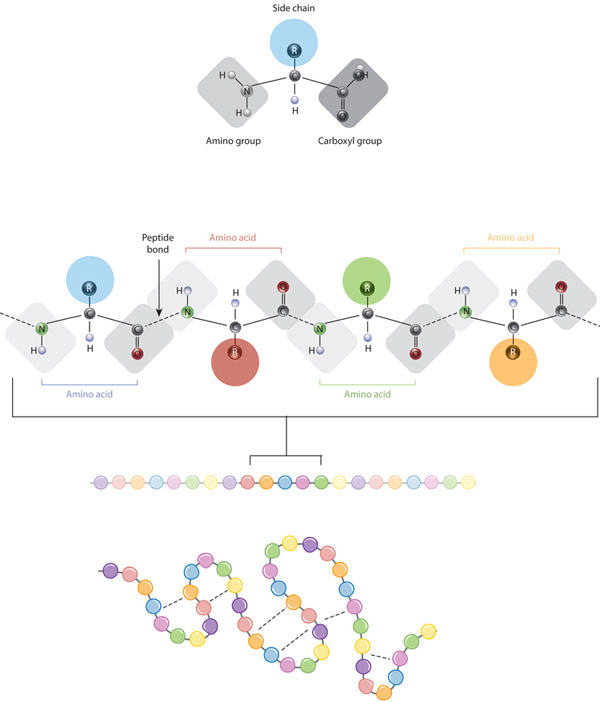
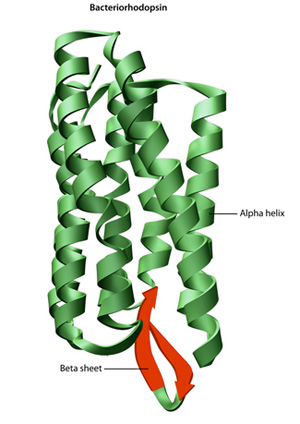
Den primære struktur af et protein — dens aminosyre sekvens — drev folde-og intramolekylære limning af den lineære aminosyre kæde, som i sidste ende bestemmer protein er unik tre-dimensionel form. Hydrogenbinding mellem aminogrupper og Carbo .ylgrupper i nærliggende områder af proteinkæden forårsager undertiden visse foldemønstre., Kendt som alfa helices og beta ark, udgør disse stabile foldemønstre den sekundære struktur af et protein. De fleste proteiner indeholder flere helices og ark, ud over andre mindre almindelige mønstre (figur 2). Ensemblet af formationer og folder i en enkelt lineær kæde af aminosyrer — undertiden kaldet et polypeptid — udgør den tertiære struktur af et protein. Endelig henviser den kvaternære struktur af et protein til de makromolekyler med flere polypeptidkæder eller underenheder.,
den endelige form vedtaget af et nyligt syntetiseret protein er typisk den mest energisk gunstige. Når proteiner foldes, tester de en række konformationer, inden de når deres endelige form, som er unik og kompakt. Foldede proteiner stabiliseres af tusinder af ikke-ovalente bindinger mellem aminosyrer. Derudover bidrager kemiske kræfter mellem et protein og dets umiddelbare miljø til proteinform og stabilitet., For eksempel har proteinerne, der opløses i cellecytoplasma, hydrofile (vandelskende) kemiske grupper på deres overflader, mens deres hydrofobe (vandaverse) elementer har tendens til at blive gemt inde. I modsætning hertil viser proteinerne, der indsættes i cellemembranerne, nogle hydrofobe kemiske grupper på deres overflade, specifikt i de regioner, hvor proteinoverfladen udsættes for membranlipider. Det er dog vigtigt at bemærke, at fuldt foldede proteiner ikke fryses i form. Snarere forbliver atomerne i disse proteiner i stand til at foretage små bevægelser.,
selvom proteiner betragtes som makromolekyler, er de for små til at visualisere, selv med et mikroskop. Så forskere skal bruge indirekte metoder til at finde ud af, hvordan de ser ud, og hvordan de foldes. Den mest almindelige metode til undersøgelse af proteinstrukturer er røntgenkrystallografi. Med denne metode anbringes faste krystaller af oprenset protein i en røntgenstråle, og mønsteret af afbøjede røntgenstråler bruges til at forudsige positionerne for de tusinder af atomer i proteinkrystallen.















