de bouwstenen van eiwitten zijn aminozuren, dit zijn kleine organische moleculen die bestaan uit een alfa (centraal) koolstofatoom gekoppeld aan een aminogroep, een carboxylgroep, een waterstofatoom en een variabele component genaamd een zijketen (zie hieronder). Binnen een proteã ne, worden de veelvoudige aminozuren verbonden door peptide banden, waardoor een lange ketting vormen., Peptidebindingen worden gevormd door een biochemische reactie die een watermolecuul extraheert aangezien het de aminogroep van één aminozuur aan de carboxylgroep van een naburig aminozuur aansluit. De lineaire opeenvolging van aminozuren binnen een proteã ne wordt beschouwd als de primaire structuur van de proteã ne.
eiwitten zijn opgebouwd uit een set van slechts twintig aminozuren, die elk een unieke zijketen hebben. De zijketens van aminozuren hebben verschillende chemie. De grootste groep aminozuren heeft niet-polaire zijketens., Verscheidene andere aminozuren hebben zijkettingen met positieve of negatieve lasten, terwijl anderen polaire maar niet geladen zijkettingen hebben. De chemie van aminozuur zijkettingen is kritiek aan eiwitstructuur omdat deze zijkettingen met elkaar kunnen binden om een lengte van proteã ne in een bepaalde vorm of bouw te houden. Geladen aminozuur zijketens kunnen Ionische banden vormen, en de polaire aminozuren kunnen waterstofbanden vormen. Hydrofobe zijketens interageren met elkaar via zwakke Van der Waals interacties. De overgrote meerderheid van de bindingen gevormd door deze zijketens zijn niet-ovalent., In feite zijn cysteines de enige aminozuren die covalente bindingen kunnen vormen, wat ze doen met hun specifieke zijketens. Wegens zijketeninteractie, de opeenvolging en de plaats van aminozuren in een bepaalde eiwitgidsen waar de bochten en vouwen in die proteã ne voorkomen (figuur 1).,
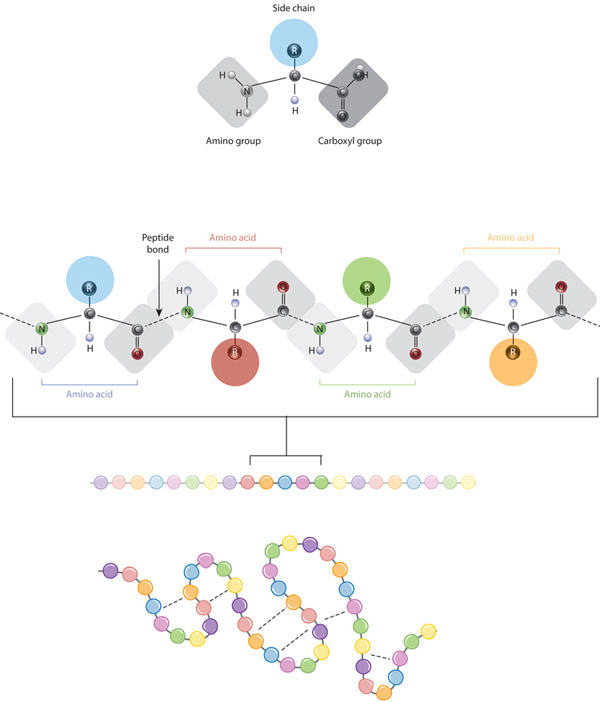
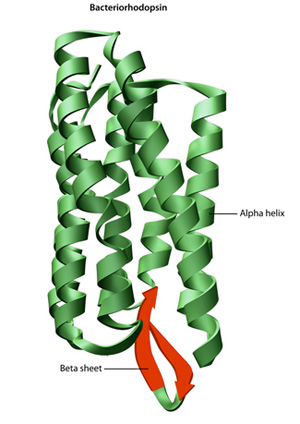
De primaire structuur van een eiwit het aminozuur sequentie — stations de vouwen en intramoleculaire hechting van de lineaire keten aminozuren, die bepaalt uiteindelijk het eiwit is een unieke drie-dimensionale vorm. Waterstof het binden tussen aminogroepen en carboxylgroepen in naburige gebieden van de eiwitketen veroorzaakt soms bepaalde patronen van het vouwen om voor te komen., Bekend als alpha helices en beta sheets, deze stabiele vouwpatronen vormen de secundaire structuur van een eiwit. De meeste proteã nen bevatten veelvoudige helices en bladen, naast andere minder gemeenschappelijke patronen (Figuur 2). Het ensemble van formaties en plooien in één enkele lineaire keten van aminozuren — soms een polypeptide genoemd — vormt de tertiaire structuur van een proteã ne. Tenslotte verwijst de quaternaire structuur van een proteã ne naar die macromoleculen met veelvoudige polypeptidekettingen of subeenheden.,
de uiteindelijke vorm die wordt aangenomen door een nieuw gesynthetiseerd eiwit is meestal de meest energetisch gunstige vorm. Als proteã NEN vouwen, testen zij een verscheidenheid van conformations alvorens hun definitieve vorm te bereiken, die uniek en compact is. Gevouwen proteã nen worden gestabiliseerd door duizenden noncovalent banden tussen aminozuren. Bovendien dragen chemische krachten tussen een eiwit en zijn directe omgeving bij aan eiwitvorm en stabiliteit., Bijvoorbeeld, hebben de proteã nen die in het celcytoplasma worden opgelost hydrofiele (water-liefhebbende) chemische groepen op hun oppervlakten, terwijl hun hydrophobic (water-averse) elementen neigen om binnen te worden verscholen. In tegenstelling, tonen de proteã nen die in de celmembranen worden opgenomen sommige hydrophobic chemische groepen op hun oppervlakte, specifiek in die gebieden waar de eiwitoppervlakte aan membraanlipiden wordt blootgesteld. Het is belangrijk om op te merken, echter, dat volledig gevouwen proteã nen niet in vorm worden bevroren. Eerder, blijven de atomen binnen deze proteã nen geschikt om kleine bewegingen te maken.,
hoewel eiwitten als macromoleculen worden beschouwd, zijn ze te klein om te visualiseren, zelfs met een microscoop. Dus, wetenschappers moeten indirecte methoden gebruiken om erachter te komen hoe ze eruit zien en hoe ze zijn gevouwen. De gemeenschappelijkste methode die aan studie eiwitstructuren wordt gebruikt is de kristallografie van de Röntgenstraal. Met deze methode, worden de stevige kristallen van gezuiverde proteã ne geplaatst in een röntgenstraal, en het patroon van afgebogen röntgenstralen wordt gebruikt om de posities van de duizenden atomen binnen het eiwitkristal te voorspellen.















