Inleiding
coagulase-negatieve stafylokokken (CoNS) zijn een heterogene groep stafylokokken die klinisch is geclassificeerd door de afwezigheid van het bloedstollingsenzym coagulase. Dit onderscheidt hen van Staphylococcus aureus en een paar klinisch minder belangrijke coagulase-positieve soorten., Vandaag, CoNS zijn de meest meestal geïsoleerde bacteriën in klinische culturen en zijn naar voren gekomen als belangrijke nosocomiale pathogenen. Risicofactoren voor CoNS-infectie zijn de aanwezigheid van inwonende medische implantaten, zoals intravasculaire katheters, of immunosuppressie als gevolg van kankerbehandeling of HIV/AIDS. Behandeling van CoNS-infecties wordt gecompliceerd door de opkomst van antibioticaresistente stammen (zoals in het bijzonder MRSE, methicilline-resistente S. epidermidis) (Rogers et al., 2009).,
CoNS zijn een integraal onderdeel van de normale flora op de menselijke huid en slijmvliezen en koloniseren bij voorkeur vochtige gebieden (Grice et al., 2009). S. epidermidis, de meest voorkomende CoNS-soorten uit klinische culturen, koloniseert de oksel, lies, voorste nares, conjunctiva, teen web en perineale gebied (Kloos en Musselwhite, 1975). Hoewel meestal onschadelijke of zelfs nuttige kolonisatoren, zodra de gastheer epitheliale barrière is aangetast, kunnen nadelen zoals S. epidermidis ernstige infecties veroorzaken., In feite zijn CoNS-infecties verantwoordelijk voor de meerderheid van bacteriële sepsis en vreemd lichaam-gerelateerde infecties, met S. epidermidis is de belangrijkste soort in dat opzicht (Rogers et al., 2009).
De gastheer-immuunrespons op S. epidermidis, het mechanisme van immuuntolerantie en de immuunvoordelen die de commensalen van S. epidermidis kunnen bieden, beginnen nog maar net te worden ontrafeld. Dit overzicht zal het laatste onderzoek leveren naar de reactie van de gastheer op S. epidermidis als commensalen, en als opportunistische bacteriën in de context van biofilm en septische infecties.,
de immuunrespons van de gastheer op S. epidermidis als commensaal
Er zijn steeds meer aanwijzingen dat de huidmicrobiota in het algemeen een belangrijke invloed heeft op het immuunsysteem (Belkaid en Tamoutounour, 2016). Ondanks CoNS zijn een van de belangrijkste huid kolonisatoren, specifieke studies over de gastheer immuunrespons op CoNS kolonisatie en vestiging zijn beperkt. Die die beschikbaar zijn hebben zich op de immune reactie op huidkolonisatie door de prototypical CoNS species S. epidermidis en de voordelen van dergelijke kolonisatie aan de gastheer gericht.,
De Gallo-groep heeft bijvoorbeeld potentieel gunstige functies van S. epidermidis beschreven als een commensaal van de huid. Namelijk, Lai et al. gemeld dat S. epidermidis lipoteichoic acid (LTA) via een mechanisme waarbij TLR (toll-like receptor) 2 betrokken is, huidontsteking vermindert (Lai et al., 2009). Dezelfde auteurs rapporteerden later ook dat S., epidermidis (maar geen andere bacteriën) produceert een niet verder gekarakteriseerde stof van minder dan 10 kD die TLR2 activeert en daardoor de productie van antimicrobiële peptiden induceert, waardoor de capaciteit van cellysaten om de groei van Groep A Streptococcus en S. aureus te remmen (Lai et al., 2010) (figuur 1A). Hoewel deze resultaten een gunstige functie van S. onderstrepen, epidermidis op de huid, wat de stimulerende factor betreft, moeten ze worden gezien in het licht van het feit dat de vaak gemelde activering van TLR2 door LTA is uitgedaagd: LTA-zuivering is extreem moeilijk en bevat vaak TLR2-stimulerende lipopeptidecontaminanten, ook in commerciële preparaten (Hashimoto et al., 2006). Om de aard van de stimulerende factor te verifiëren, moeten deze bevindingen dus zeker verder worden beoordeeld met behulp van isogene mutanten van S. epidermidis.
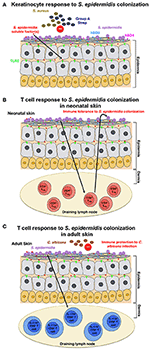
figuur 1., Model van de gastheerrespons op S. epidermidis kolonisatie (A) S. epidermidis koloniseert de huidepidermis, een sterk georganiseerde structuur die voornamelijk bestaat uit keratinocyten. Als reactie op de kolonisatie van S. epidermidis binden patroonherkenningsreceptoren (PRR ‘ s) zoals TLR2 op keratinocyten aan slecht gekarakteriseerde factor(n) die door S. epidermidis wordt afgescheiden om een signaalcascade te stimuleren die bijvoorbeeld resulteert in de productie van de antimicrobiële peptiden β-defensin 2 (hBD2) en hBD3. Deze antimicrobiële peptiden bieden bescherming tegen cutane S. aureus en groep A Streptococcus infecties., (B) de kolonisatie van S. epidermidis induceert een specifieke CD4+ FOXP3+ Treg-respons, die essentieel is voor de immuuntolerantie ten opzichte van S. epidermidis als commensaal. Immune tolerantie wordt verondersteld om te worden vastgesteld alleen tijdens de neonatale periode, als kolonisatie in volwassen muizen faalde om tolerantie vast te stellen. (C) in een ander model, gebaseerd op resultaten verkregen bij volwassen muizen, veroorzaakt huidkolonisatie door S. epidermidis een specifieke IL-17A+ CD8+ T-celreactie., Geprimed in de huid drainerende lymfeklieren door CD103 + dendritische cellen, deze T-cellen verbeteren de aangeboren antimicrobiële verdediging en voorkomen invasie door de schimmel, C. albicans.
Scharschmidt et al. toonde aan dat kolonisatie met S. epidermidis een lokale, evenals systemische, specifieke CD4+ T-celrespons veroorzaakte, zoals aangetoond door de verrijking van specifieke CD4 + T-cellen in zowel de huid drainerende lymfeklieren als de milt (Scharschmidt et al., 2015). Deze groep heeft de S. ontworpen., de huid van epidermidis isoleert, stam Tü3298, om het peptide antigeen 2W (Epi-2W), gekoppeld aan een fluorescerend eiwit, tot expressie te brengen. Om kolonisatie te bereiken, pasten ze 108-109 CFUs van de gemanipuleerde EPI-2W-stam toe op de dorsale huid van c57bl/6 muizen om de 3 dagen voor in totaal drie toepassingen. Met behulp van dit model illustreerden de auteurs dat uitbreiding van specifiek CD4+ regulerende T (Treg) cellen een cruciale rol speelt in de immuuntolerantie voor S. epidermidis., Een dergelijke tolerantie vereiste echter vroege bacteriële kolonisatie tijdens het neonatale Stadium, aangezien kolonisatie bij volwassen muizen geen tolerantie vaststelde (figuur 1B). Het werk van Scharschmidt et al. is vooral intrigerend aangezien het de wetenschappelijke grondgedachte voor de modulatie van de huidmicrobiota in de neonatale periode verstrekt als therapeutische optie om inflammatoire huidziekten te behandelen, en in het bijzonder, voor atopic dermatitis (AD).
de huid van AD-patiënten wordt vaak gekoloniseerd door S. aureus (Higaki et al., 1999). Verschillende studies tonen aan dat S., epidermidis is de op een na meest voorkomende microbe geïsoleerd uit AD-aangetaste huidlaesies (Hon et al., 2005, 2012, 2016). Hoewel dit S. epidermidis niet direct impliceert in de pathogenese van AD, vanwege zijn normale en frequente overvloed op de huid, in de meest recente van die studies, Hon et al. onderzocht bacteriële isolaten van 100 AD-patiënten en vond dat S. epidermidis aanwezig is in de ernstigste ad-aangetaste huidlaesies (Hon et al., 2016). Dus, de eerder voorgestelde antagonistische relatie tussen S. epidermidis en S. aureus (Cogen et al., 2010; Iwase et al.,, 2010), niet vertaald naar minder ziekte in hun studie. In plaats daarvan suggereerden de resultaten dat de kolonisatie van S. epidermidis geassocieerd is met ernstigere AD-ziekte. Er zijn zeker verdere studies nodig om de rol van S. epidermidis bij de pathogenese van AD en de aard van de relatie tussen S. aureus en S. epidermidis bij de laesies van AD te evalueren.
Naik et al. aangetoond dat kolonisatie van S. epidermidis bij volwassen muizen een huidspecifieke T-celrespons induceert (Naik et al., 2015). In deze studie, de groep toegepast ~5 ml van 107-109 CFU per ml S., epidermidis over het gehele huidoppervlak van de muis om de andere dag voor een totaal van vier toepassingen, een procedure waarmee ze gemeld stabiele kolonisatie te verkrijgen. De T-cellen die in deze studie werden geïnduceerd, waren echter IL-17A+ CD8+ T-cellen in plaats van CD4+ T-cellen, zoals in de Scharschmidt et al. studie (Scharschmidt et al., 2015). De auteurs toonden aan dat deze IL-17A+ CD8+ T-cellen immuniteit voor cutane C. albicans-infectie (figuur 1C) leverden; zij onderzochten echter niet of dit ook immuniteit biedt voor andere pathogenen, met name S. aureus (Naik et al., 2015).,
beide Scharschmidt et al. en Naik et al. studies onderzochten de gastheer immuunrespons op S. epidermidis kolonisatie, maar hun bevindingen zijn heel anders. Deze verschillen kunnen worden toegeschreven aan de nuances in de opstelling van de muismodellen of mogelijk ook aan de specifieke S. epidermidis stammen die worden gebruikt. Ondanks de verschillen in de resultaten toonden de twee studies gezamenlijk aan dat kolonisatie met S. epidermidis bij muizen een adaptieve T-celrespons induceert. Het is echter onduidelijk of een dergelijke immuunsignatuur voor kolonisatie van S. epidermidis ook bij mensen wordt waargenomen.,
immuniteit tegen S. epidermidis bij Biofilm-geassocieerde infecties
zeer weinig studies zijn uitgevoerd om de immuunrespons op CoNS-biofilm-geassocieerde infecties te beoordelen, vooral in vergelijking met S. aureus. De meeste van deze studies hebben zich gericht op S. epidermidis. CoNS biofilm-geassocieerde infecties komen vaak voor bij patiënten met medische implantaten, met S. epidermidis is de meest waarschijnlijke soort te worden hersteld (Rogers et al., 2009)., Biofilms zijn complexe, ruimtelijk diverse agglomeraties van bacteriële cellen ingesloten in een amorfe, zelf geproduceerde extracellulaire matrix samengesteld uit extracellulair DNA, eiwitten en polysacchariden (Otto, 2008). Biofilm-geassocieerde infecties zijn extreem resistent tegen antibiotische behandeling om verschillende redenen, waaronder verminderde stofwisseling en belemmerde penetratie door de extracellulaire matrix (Mah en O ‘ Toole, 2001). Daarom vereist de behandeling vaak chirurgische verwijdering van het geïnfecteerde apparaat of weefsel., Alleen al in de VS wordt jaarlijks ongeveer 2 miljard dollar besteed aan de behandeling en behandeling van orthopedische implantaatgerelateerde infecties (Darouiche, 2004; Parvizi et al., 2010).
in het algemeen is de immuunrespons van de gastheer op een met S. epidermidis biofilm geassocieerde infectie niet Beschermend of voldoende om de infectie te verwijderen. Vandaar dat de meeste S. epidermidis biofilm-geassocieerde infecties chronisch zijn. De meeste studies die over het onderwerp tot nu toe worden uitgevoerd zijn in-vitro studies die biofilm-grown vergeleken met planktonic bacteriën. Resultaten van verschillende studies suggereren dat S., biofilms van epidermidis induceren de verzwakking van de fagocytaire functie en de productie van ontstekingsremmende cytokines in vergelijking met hun planktonische tegenhangers (Figuur 2). Er zijn tegenstrijdige bevindingen gerapporteerd over de effecten van biofilms van S. epidermidis op de fagocytaire activiteit. Twee studies rapporteerden dat therapietrouw en fagocytose door menselijke neutrofielen en primaire menselijke monocyt-afgeleide macrofagen significant werden versterkt wanneer gestimuleerd met biofilm-gekweekte bacteriën (Heinzelmann et al., 1997; Spiliopoulou et al.,, 2012), terwijl anderen meldden dat de biofilm exopolysaccharide, polysaccharide intercellular adhesine (PIA) (Mack et al., 1996) speelt een essentiële rol in de verzwakking van de fagocytaire capaciteit van muriene peritoneale macrofagen (Shiau and Wu, 1998), j774a.1 muriene macrofagen (Schommer et al., 2011), en human PMNs. Er bestaat echter consensus in de literatuur over de effecten van S. epidermidis biofilm op fagocytaire doding. Doden door menselijke macrofagen (Spiliopoulou et al., 2012) en PMNs (Vuong et al., 2004; Kristian et al.,, 2008) evenals antilichaam-gemedieerde doden door leukocyten (Cerca et al., 2006) sterk verzwakt in aanwezigheid van biofilm-gekweekte bacteriën.
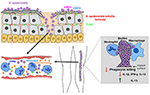
Figuur 2. Model van de gastheer respons op S. epidermidis infecties. Het doorbreken van de huid kan leiden tot verspreiding van S. epidermidis in de bloedbaan om bacteriëmie en acute gevallen van sepsis te veroorzaken., Gastheerimmuniteit tegen septische infecties is sterk afhankelijk van neutrofielen, complement, evenals activering van PRRs met inbegrip van G-eiwit gekoppelde receptoren (GPCRs) zoals TLR2 (groen) en FPR2 (blauw). Biofilm-geassocieerde infecties op medische implantaten zijn afkomstig van contaminaties tijdens het inbrengen van het apparaat of, in zeldzame gevallen, uit de bloedbaan. Patiënten met medische implantaten zijn gevoelig voor sepsis van S. epidermidis, omdat biofilmbacteriën vaak in de bloedbaan kunnen verspreiden., De immune reactie op biofilm-geassocieerde besmettingen wordt over het algemeen verondersteld om niet efficiënt te zijn, aangezien biofilms fagocytic het doden door PMNs en macrophages remmen. Bovendien scheef het immuunsysteem in de richting van verbeterde productie van anti-inflammatoire cytokines zoals IL-13 terwijl het beperken van de secretie van pro-inflammatoire cytokines, met inbegrip van IL1-beta, IL-12, en IFN-gamma.
de rol van complement bij met biofilm geassocieerde infecties is vrij onduidelijk. Terwijl S., epidermidis biofilm-producerende stammen wekken een sterkere respons op bij de activering en afgifte van complementcomponenten dan hun isogene PIA-negatieve en dus biofilm-negatieve tegenhangers (Kristian et al., 2008; Fredheim et al., 2011), een dergelijke aanvulling release niet vertalen naar verbeterde fagocytaire doden. S. epidermidis Pia-positieve biofilms veroorzaakten C3A-afgifte, maar beschermden S. epidermidis tegen C3B-en IgG-opsonisatie en pmn-gemedieerde doden (Kristian et al., 2008)., Met name-terwijl sommige auteurs probeerden om specifieke effecten toe te schrijven aan PIA, in plaats van biofilm vorming, door mechanisch vernietigen aggregaten (Vuong et al. In geen van deze studies kan een duidelijk onderscheid worden gemaakt tussen de effecten van biofilm agglomeraties en een direct effect van exopolysaccharide PIA. Wat betreft de beweerde pro-inflammatoire eigenschappen van PIA (Kristian et al., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), maken de feiten dat PIA een moeilijk te zuiveren substantie is en de isogene Pia-negatieve mutanten duidelijk verschillende eigenschappen van het celoppervlak hebben, het moeilijk om waargenomen gevolgen direct aan de PIA-molecule toe te schrijven.
Er is gemeld dat S. epidermidis biofilm-gekweekte stammen de productie van anti-inflammatoire in plaats van pro-inflammatoire cytokines (Spiliopoulou et al., 2012). In de respectieve studie, primaire menselijke monocyt-afgeleide macrofagen gestimuleerd met levende S., epidermidis uit 24-uur biofilms produceerde lagere niveaus van pro-inflammatoire cytokines (IL-1beta, IFN-gamma, IL-12) en verhoogde niveaus van de anti-inflammatoire cytokine IL-13 dan planktonische cellen gegroeid gedurende 2 uur. Uiteraard, in die vergelijking andere factoren, zoals met name quorum-sensing gereguleerde pro-inflammatoire factoren zoals de fenol-oplosbare modulines (PSMS) (Cheung et al., 2014) hieronder besproken, kan verantwoordelijk worden gemaakt voor de waargenomen verschillen eerder dan biofilm vorming zelf., Echter, het vergelijken van biofilm-positieve met isogene biofilm-negatieve (Pia-negatieve, Embp, of Aap-negatieve) stammen, Schommer et al. er werd ook een verminderde ontstekingsreactie waargenomen bij 774a. 1 macrofagen met verminderde NF-kappaB-activering en verminderde IL – 1beta-productie (Schommer et al., 2011).
Er is weinig bekend over de manier waarop het adaptieve immuunsysteem reageert op biofilm-geassocieerde infecties, deels omdat het moeilijk is om langdurige S. epidermidis biofilm-infectiemodellen vast te stellen. Vuong et al. hebben een katheter-gerelateerd muriene infectie model ontwikkeld met een S., epidermidis bioluminescente stam genaamd SE Xen43, waarmee ze in real-time de progressie van S. epidermidis biofilm-geassocieerde infectie (Vuong et al., 2008). Bij vergelijking van de gevoeligheid van Nu/Nu (t-celdeficiënt) en CBSCBG-MM (T/B-celdeficiënt) voor S. epidermidis biofilm-geassocieerde infectie met immunocompetente wild-type Balb/C-muizen, stelden de auteurs vast dat met name de Nu/Nu-muizen gevoeliger waren voor infectie, wat wijst op een belangrijke rol van t-celgemedieerde immuniteit tegen S. epidermidis biofilm-geassocieerde infectie.
immuniteit tegen S., epidermidis tijdens Sepsis
de aanwezigheid van CoNS in het bloed (bacteriëmie), vaak afkomstig van de verspreiding van bacteriën uit biofilms op inwonende medische hulpmiddelen, kan acute sepsis veroorzaken (Figuur 2). CoNS bacteriëmie wordt geassocieerd met significante gezondheidszorgkosten, morbiditeit en mortaliteit (Bearman en Wenzel, 2005). Immuungecompromitteerde en premature pasgeborenen zijn het meest kwetsbaar voor CoNS sepsis, waarbij S. epidermidis de meest voorkomende CoNS-soorten is (Cheung and Otto, 2010).
in tegenstelling tot chronische infecties met S. epidermidis biofilm, S., sepsis van epidermidis is acuut van aard. Daarom is de gastheer immuunrespons op S. epidermidis sepsis, die grotendeels plaatsvindt in de bloedbaan, heel anders dan die tegen Weefsel-Resident S. epidermidis biofilm geassocieerde infecties. Aangezien pasgeborenen een verhoogde gevoeligheid hebben voor sepsis van S. epidermidis, hadden de meeste studies over deze kwestie betrekking op neonatale sepsis van S. epidermidis. Daarom zal de volgende discussie gericht zijn op neonatale immuniteit als reactie op sepsis van S. epidermidis.,
een belangrijk element in de aangeboren immuunrespons zijn aangeboren immuuncellen, waaronder neutrofielen domineren in aantal. Neutrophils erkennen binnenvallende microben via een repertoire van gastheerreceptoren (zie hieronder), nemen hen in, en elimineren hen binnen phagosome door reactieve zuurstofspecies en antimicrobial proteã nen die tijdens een proces genoemd degranulation worden vrijgegeven (Malech et al., 2014). Bovendien kunnen lysed neutrophils neutrophil extracellular vallen (Netten) vormen om binnenvallende microben te binden en te doden (Brinkmann et al., 2004).,
verscheidene patroonherkenningsreceptoren (PRRS), die behouden microbiële producten (PAMPs, pathogeen-geassocieerde moleculaire patronen) herkennen en daaraan binden en die een essentiële rol spelen bij de activering van de aangeboren immuunrespons, blijken kritisch te zijn voor de gastheerimmuniteit tegen sepsis van S. epidermidis. TLR2 bleek kritisch te zijn voor de klaring van S. epidermidis in een muizensepsismodel (Strunk et al., 2010). Bij menselijke pasgeborenen is er een toename in TLR2-expressie in de loop van S. epidermidis sepsis (Viemann et al.,, 2005) werd echter gemeld dat een TLR-gestimuleerde immuunsysteem minder bekwaam was in het opwekken van meerdere cytokine responsen bij pasgeborenen dan bij volwassenen (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001), en lipoteichoic acid (LTA) (Xia et al., 2016) zijn geclaimd effectors van TLR2 te zijn. Studies met PIA en PSMs werden echter niet geverifieerd met isogene mutanten; en wat LTA betreft, is er recent bewijs dat stafylokokkenlipopeptiden eerder dan LTA de echte immuunstimulerende middelen zijn (Hashimoto et al., 2006)., Verder werd in S. aureus aangetoond dat PSMs geen directe agonisten van TLR2 zijn, maar tot de versie van lipopeptiden van het celoppervlak leiden en zo een secundair, TLR2-stimulerend effect hebben (Hanzelmann et al., 2016), een effect dat waarschijnlijk ook voorkomt bij S. epidermidis.
gebaseerd op het feit dat de formylpeptide receptor 2 (FPR2) PSMS herkent (Kretschmer et al., 2010), is deze g-eiwitgekoppelde chemoattractantreceptor een andere potentieel belangrijke gastheerreceptor in de reactie tegen S. epidermidis. Zoals aangegeven in S., aureus, PSM-FPR2 activatie induceert chemotaxis, granule exocytose, en interleukine-8 (IL-8) versie van PMNs (Wang et al., 2007; Kretschmer et al., 2010). Studies naar de effecten van PSM ’s van CoNS op de immuunrespons zijn alleen uitgevoerd met zuivere PSM’ s van S. epidermidis (Cheung et al., 2010), en tot nu toe zijn gehinderd door de veelheid van genetische PSM loci in S. epidermidis en de Algemene moeilijkheid om isogene deletie mutanten in CoNS te produceren. Echter, een recente studie toegeschreven een cruciale rol aan de mobiele genetisch-element-gecodeerde, hoog geproduceerde PSM-mec van S., epidermidis bij ontsteking en immuunontduiking, waarbij gebruik wordt gemaakt van isogene psm-mec mutanten (Qin et al., 2017).
aanvulling speelt ook een belangrijke rol in de immuniteit tegen sepsis van S. epidermidis. Deficiënties in complementfactor C3 en IgG worden geassocieerd met een hoger risico op neonatale CoNS-geassocieerde sepsis (Lassiter et al., 1991). Bovendien induceerde S. epidermidis in een onderzoek waarbij gebruik werd gemaakt van een ex-vivo volbloedsepsismodel significant lagere complementactivering bij neonataal bloed in vergelijking met volwassen bloed (Granslo et al., 2013)., Deze bevinding suggereert dat er een maturatiedeficiëntie is in het neonatale complementsysteem, wat deels kan verklaren waarom pasgeborenen gevoeliger zijn voor septische infecties van S. epidermidis dan volwassenen. Bovendien benadrukt deze studie het belang van het complementsysteem in de verdediging van de gastheer tegen sepsis van S. epidermidis.
net als een complement vertonen neutrofielen van te vroeg geboren pasgeborenen maturatiedeficiëntie. Ze vertonen een verminderde oxidatieve uitbarsting in vergelijking met die geïsoleerd uit de term pasgeborenen wanneer gestimuleerd met S. epidermidis (Björkqvist et al., 2004)., Dit kan voor een deel ook de verhoogde gevoeligheid bij premature pasgeborenen voor sepsis van S. epidermidis verklaren. Interessant genoeg zijn monocyten, een andere cellulaire component in de aangeboren immuunrespons, niet essentieel voor de verdediging van de gastheer tegen neonatale sepsis van S. epidermidis, aangezien zowel menselijke neonatale als volwassen monocyten vergelijkbare fagocytische en intracellulaire dodende capaciteit vertoonden (Strunk et al., 2007). Dit alles wijst erop dat neutrofielen een bijzonder belangrijke rol spelen in de immuunrespons tijdens sepsis van S. epidermidis.,
hoewel er talrijke studies zijn gewijd aan het begrijpen van de rol van de aangeboren immuunrespons tijdens sepsis van S. epidermidis, blijft onderzoek naar de rol van de adaptieve immuunrespons bij septische infecties van S. epidermidis beperkt. Aangezien deze infecties acuut van aard zijn, is het onwaarschijnlijk dat de adaptieve immuunrespons een belangrijke rol speelt. Bijgevolg kon intraveneuze overdracht van immunoglobuline van donoren met hoge titers antilichamen tegen S. epidermidis of S. aureus niet beschermen tegen sepsis bij te vroeg geboren pasgeborenen (Bloom et al., 2005; DeJonge et al., 2007).,
conclusies
CoNS-infecties en met name S. epidermidis vormen een aanzienlijke medische en economische belasting voor de openbare gezondheidszorg. Bovendien, met de opkomst van antibioticaresistentie, worden de behandelingsopties beperkt. Echter, de eliminatie van S. epidermidis bacteriën lijkt ongepast, omdat ze een integraal onderdeel van de gunstige microbiota op de huid en slijmvliezen.
de gunstige rol van S., epidermidiskolonisatie bij de preventie van overgroei van pathogenen op de huid, Gebaseerd op resultaten bij muizen, is toegeschreven aan stimulatie van de immuunrespons. Met het muizenhuid-model dat nauwelijks de situatie op de menselijke huid weerspiegelt, blijft het echter slecht begrepen of de bevindingen overdraagbaar zijn op de mens. Verder moet nog worden onderzocht of er een rol is van potentiële directe bacteriële interactie tussen S. epidermidis en pathogenen op de huid.
de immuunrespons op S. epidermidis tijdens infectie is mogelijk nog minder goed begrepen., In chronische, biofilm-geassocieerde besmetting is het moeilijk om tussen gevolgen van afschuifagglomeratie en die te onderscheiden die door specifieke componenten van de celoppervlakte worden bemiddeld. Tijdens sepsis blijven de aard en de rol van pro-inflammatoire cytokines en ontstekingsroutes als reactie op S. epidermidis even slecht gedefinieerd. Opheldering van deze mechanismen zal ook meer informatie opleveren over de vraag waarom pasgeborenen bijzonder gevoelig zijn voor S. epidermidis-infectie. Vooruitgang die is geboekt met betrekking tot moleculaire biologie tools voor S., epidermidis en CoNS in het algemeen zullen een grote hulp zijn bij deze inspanningen en in het bijzonder helpen bij het onderscheiden tussen directe en secundaire effecten. Het is duidelijk dat een dieper inzicht in de immuunrespons van de gastheer op deze infecties van cruciaal belang zal zijn voor de ontwikkeling van S. epidermidis vaccins en nieuwe therapieën.
Auteursbijdragen
TN en MO schreven het manuscript. MP en TN hebben cijfers opgesteld.,
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
bevestigingen
deze studie werd ondersteund door het intramurale Onderzoeksprogramma van het National Institute of Allergy and Infectious Diseases (NIAID), U. S. National Institutes of Health (NIH), projectnummer ZIA AI001080.
Kloos, W. E., and Musselwhite, M. S. (1975)., Verspreiding en persistentie van Staphylococcus-en Micrococcus-soorten en andere aërobe bacteriën op de menselijke huid. Appl. Microbiol. 30, 381–385.
PubMed Abstract / Google Scholar















