wprowadzenie
gronkowce koagulazo-ujemne (CoNS) są heterogeniczną grupą gatunków gronkowców sklasyfikowanych klinicznie przez brak enzymu krzepnięcia krwi koagulazy. To odróżnia je od Staphylococcus aureus i kilku klinicznie mniej ważnych gatunków koagulazo-dodatnich., Obecnie CoNS są najczęściej izolowanymi bakteriami w kulturach klinicznych i pojawiły się jako główne patogeny szpitalne. Czynniki ryzyka zakażenia CoNS obejmują obecność zamieszkujących implantów medycznych, takich jak cewniki wewnątrznaczyniowe, lub immunosupresji z powodu leczenia raka lub HIV / AIDS. Leczenie zakażeń CoNS komplikuje pojawienie się szczepów opornych na antybiotyki (takich jak szczególnie MRSE, oporny na metycylinę S. epidermidis) (Rogers et al., 2009).,
wady są integralną częścią normalnej flory na ludzkiej skórze i błonach śluzowych, i preferencyjnie kolonizować wilgotne obszary (Grice et al., 2009). S. epidermidis, najczęstsze gatunki CoNS odzyskane z kultur klinicznych, kolonizuje pachy, pachwiny, przednie narce, spojówki, pajęczyny palców i okolice krocza (Kloos and Musselwhite, 1975). Podczas gdy zwykle nieszkodliwe lub nawet korzystne kolonizatorów, gdy bariera nabłonka gospodarza jest zagrożona, wady, takie jak S. epidermidis może powodować poważne infekcje., W rzeczywistości infekcje CoNS stanowią większość bakteryjnej posocznicy i zakażeń związanych z ciałem obcym, przy czym S. epidermidis jest najbardziej znaczącym gatunkiem pod tym względem(Rogers et al., 2009).
odpowiedź immunologiczna gospodarza na S. epidermidis, mechanizm tolerancji immunologicznej i korzyści immunologiczne, które mogą zapewnić komensale S. epidermidis, dopiero zaczynają być odkrywane. Ta recenzja dostarczy najnowszych badań na temat odpowiedzi gospodarza na S. epidermidis jako komensals i jako oportunistycznych bakterii w kontekście biofilmu i zakażeń septycznych.,
odpowiedź immunologiczna gospodarza na S. epidermidis jako Komensal
istnieje coraz więcej dowodów na to, że mikrobiota skóry ogólnie ma istotny wpływ na układ odpornościowy (Belkaid i Tamoutounour, 2016). Pomimo, że CoNS jest jednym z najważniejszych kolonizatorów skóry, specyficzne badania nad odpowiedzią immunologiczną gospodarza na kolonizację i osiedlanie CoNS zostały ograniczone. Te, które są dostępne, skupiły się na odpowiedzi immunologicznej na kolonizację skóry przez prototypowy Gatunek CoNS gatunek S. epidermidis i korzyści, jakie taka kolonizacja zapewnia gospodarzowi.,
na przykład Grupa Gallo opisała potencjalnie korzystne funkcje S. epidermidis jako komensalu skóry. Mianowicie, Lai et al. poinformował, że S. epidermidis kwas lipoteichoic (LTA) poprzez mechanizm obejmujący TLR (toll-like receptor) 2 zmniejsza zapalenie skóry (Lai et al., 2009). Ci sami autorzy również później donosili, że S., epidermidis (ale nie inne bakterie) produkuje dalej scharakteryzowana substancja poniżej 10 kD, która aktywuje TLR2, a tym samym indukuje produkcję peptydów przeciwbakteryjnych, co zwiększa zdolność lizatów komórkowych do hamowania wzrostu Streptococcus grupy A i S. aureus (Lai et al., 2010) (rys. 1A). Podczas gdy wyniki te podkreślają korzystną funkcję S., naskórek na skórze, jeśli chodzi o czynnik stymulujący, należy je postrzegać w świetle faktu, że często zgłaszana aktywacja TLR2 przez LTA została zakwestionowana: oczyszczanie LTA jest niezwykle trudne i często zawiera stymulujące TLR2 zanieczyszczenia lipopeptydowe, w tym w preparatach komercyjnych (Hashimoto et al., 2006). Wyniki te z pewnością wymagają dalszej oceny z wykorzystaniem izogennych mutantów S. epidermidis w celu sprawdzenia charakteru czynnika stymulującego.
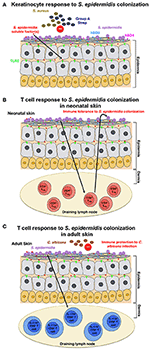
Rysunek 1., Model odpowiedzi gospodarza na kolonizację S. epidermidis (A) S. epidermidis kolonizuje naskórek skóry, wysoce zorganizowaną strukturę złożoną głównie z keratynocytów. W odpowiedzi na kolonizację S. epidermidis, receptory rozpoznawania wzorców (PRRS), takie jak TLR2 na keratynocytach, wiążą się ze słabo scharakteryzowanymi czynnikami wydzielanymi przez S. epidermidis, aby stymulować kaskadę sygnalizacyjną, która skutkuje na przykład produkcją peptydów przeciwbakteryjnych β-defenzyny 2 (hBD2) i hBD3. Te antybakteryjne peptydy zapewniają ochronę przed skórnymi zakażeniami S. aureus i paciorkowcami z grupy A., B) kolonizacja S. epidermidis wywołuje specyficzną odpowiedź CD4+ FOXP3 + Treg, która jest niezbędna dla tolerancji immunologicznej wobec S. epidermidis jako komensalu. Uważa się, że tolerancja immunologiczna została ustalona dopiero w okresie noworodkowym, ponieważ kolonizacja u dorosłych myszy nie zdołała ustalić tolerancji. C) w innym modelu, na podstawie wyników uzyskanych u dorosłych myszy, kolonizacja skóry przez S. epidermidis wywołuje specyficzną odpowiedź limfocytów T IL-17A + CD8+., Zagruntowane w skórze drenującej węzeł chłonny przez komórki dendrytyczne CD103+, te komórki T wzmacniają wrodzoną obronę przeciwdrobnoustrojową i zapobiegają inwazji grzyba, C. albicans.
Scharschmidt et al. wykazano, że kolonizacja z S. epidermidis wywołała lokalną, jak również ogólnoustrojową, specyficzną odpowiedź limfocytów T CD4+, co wykazano przez wzbogacenie specyficznych komórek T CD4+ zarówno w węzłach chłonnych odprowadzających skórę i śledzionie (Scharschmidt et al., 2015). Grupa ta opracowała S., izolat skóry naskórka, szczep Tü3298, do ekspresji antygenu peptydowego 2W (Epi-2W) związanego z białkiem fluorescencyjnym. Aby osiągnąć kolonizację, nanosili 108-109 CFU zmodyfikowanego szczepu Epi-2W na skórę grzbietową myszy C57BL/6 co 3 dni, w sumie trzy aplikacje. Wykorzystując ten model, autorzy zilustrowali, że ekspansja specyficznie CD4 + regulatorowych komórek T (Treg) odgrywa kluczową rolę w tolerancji immunologicznej na S. epidermidis., Taka tolerancja wymagała jednak wczesnej kolonizacji bakteryjnej w okresie noworodkowym, ponieważ kolonizacja u dorosłych myszy nie ustanowiła tolerancji (ryc. 1B). Praca Scharschmidt et al. jest szczególnie intrygujący, ponieważ zapewnia naukowe uzasadnienie modulacji mikrobioty skóry w okresie noworodkowym jako opcji terapeutycznej w leczeniu zapalnych chorób skóry, w szczególności w przypadku atopowego zapalenia skóry (AD).
skóra chorych na AD jest często skolonizowana przez S. aureus (Higaki et al., 1999). Z kilku badań wynika, że S., epidermidis jest drugim najczęstszym mikrobem wyizolowanym z zmian skórnych dotkniętych AD (Hon et al., 2005, 2012, 2016). Chociaż nie implikuje to bezpośrednio S. epidermidis w patogenezie AD, ze względu na jego normalną i częstą obfitość na skórze, w najnowszych badaniach Hon et al. zbadano Izolaty bakterii od 100 pacjentów AD i stwierdzono, że S. epidermidis jest obecny w najcięższych zmianach skórnych dotkniętych AD (Hon et al., 2016). Tak więc sugerowany wcześniej antagonistyczny związek między S. epidermidis i S. aureus (Cogen et al., 2010; Iwase i in.,, 2010), nie przekładały się w swoich badaniach na mniejszą chorobę. Wyniki sugerują raczej, że kolonizacja S. epidermidis jest związana z cięższą chorobą AD. Z pewnością konieczne są dalsze badania w celu oceny roli S. epidermidis w patogenezie AD oraz charakteru związku między S. aureus i S. epidermidis w zmianach AD.
wykazano, że kolonizacja S. epidermidis u dorosłych myszy indukuje specyficzną dla skóry odpowiedź limfocytów T (Naik et al., 2015). W tym badaniu grupa zastosowała ~5 ml 107-109 CFU na ml S., naskórek na całej powierzchni skóry myszy co drugi dzień, w sumie cztery aplikacje, procedura, w której zgłaszane do uzyskania stabilnej kolonizacji. Jednak komórki T indukowane w tym badaniu były limfocytami T IL-17A + CD8+, a nie limfocytami T CD4+, jak w scharschmidt et al. badanie (Scharschmidt et al., 2015). Autorzy wykazali, że te limfocyty T IL-17A+ CD8+ zapewniają odporność na infekcję skórną C. albicans (ryc. 1C); jednak nie zbadali, czy zapewnia to również odporność na inne patogeny, zwłaszcza S. aureus (Naik et al., 2015).,
zarówno Scharschmidt i in. i Naik i in. badania badały odpowiedź immunologiczną gospodarza na kolonizację S. epidermidis, jednak ich wyniki są zupełnie inne. Różnice te można przypisać niuansom w konfiguracji modeli myszy lub być może także specyficznym szczepom S. epidermidis stosowanym. Pomimo różnic w wynikach, oba badania wykazały, że kolonizacja z S. epidermidis indukuje adaptacyjną odpowiedź limfocytów T u myszy. Nie jest jednak jasne, czy taki znak odporności na kolonizację S. epidermidis obserwuje się również u ludzi.,
Odporność Na S. epidermidis w zakażeniach związanych z biofilmem
przeprowadzono bardzo niewiele badań w celu oceny odpowiedzi immunologicznej na zakażenia związane z biofilmem, zwłaszcza w porównaniu z S. aureus. Większość badań skupiła się na S. epidermidis. Infekcje związane z biofilmem często występują u pacjentów z implantami medycznymi, przy czym S. epidermidis jest najbardziej prawdopodobnym gatunkiem do odzyskania (Rogers et al., 2009)., Biofilmy są złożonymi, zróżnicowanymi przestrzennie aglomeracjami komórek bakteryjnych zamkniętymi w amorficznej, wytwarzanej przez siebie macierzy pozakomórkowej złożonej z pozakomórkowego DNA, białek i polisacharydów (Otto, 2008). Zakażenia związane z biofilmem są niezwykle odporne na leczenie antybiotykami z kilku powodów, w tym z powodu zmniejszonego metabolizmu i utrudnionej penetracji przez macierz zewnątrzkomórkową (Mah I O ' Toole, 2001). W związku z tym leczenie często wymaga chirurgicznego usunięcia zainfekowanego urządzenia lub tkanki., W samych Stanach Zjednoczonych rocznie wydaje się około 2 miliardów dolarów na leczenie i leczenie zakażeń związanych z implantami ortopedycznymi (Darouiche, 2004; Parvizi et al., 2010).
ogólnie rzecz biorąc, odpowiedź immunologiczna gospodarza na zakażenie związane z biofilmem S. epidermidis nie jest ochronna lub wystarczająca do usunięcia zakażenia. W związku z tym większość zakażeń związanych z biofilmem S. epidermidis jest przewlekła. Większość badań prowadzonych na ten temat do tej pory są badania in vitro, które porównują biofilm uprawiane i bakterie planktoniczne. Wyniki kilku badań sugerują, że S., biofilmy naskórka wywołują osłabienie funkcji fagocytarnej i produkcję cytokin przeciwzapalnych w porównaniu z ich planktonicznymi odpowiednikami (ryc. 2). Zgłaszano sprzeczne wyniki dotyczące wpływu biofilmów S. epidermidis na aktywność fagocytarną. Dwa badania wykazały, że adhezja i fagocytoza ludzkich neutrofilów i pierwotnych ludzkich makrofagów pochodzących z monocytów były znacznie nasilone po stymulacji bakteriami hodowanymi w biofilmie (Heinzelmann et al., 1997; Spiliopoulou et al.,, 2012), podczas gdy inni donosili, że egzopolisacharyd biofilmu, adhezyna międzykomórkowa polisacharydu (Pia) (Mack et al., 1996) odgrywa istotną rolę w tłumieniu phagocytic capacity of murine peritoneal macrophages (Shiau and Wu, 1998), j774a. 1 murine macrophages (Schommer et al., 2011) oraz human PMNs. W literaturze istnieje jednak konsensus co do wpływu biofilmu S. epidermidis na zabijanie fagocytarne. Zabijanie przez ludzkie makrofagi (Spiliopoulou et al., 2012) i PMNs (Vuong et al., 2004; Kristian et al.,, 2008), a także zabijanie za pośrednictwem przeciwciał przez leukocyty (Cerca et al., 2006) są silnie atenuowane w obecności bakterii hodowanych w biofilmie.
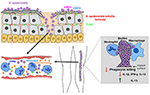
Rysunek 2. Model odpowiedzi gospodarza na infekcje S. epidermidis. Przebicie przez skórę może spowodować rozprzestrzenianie się S. epidermidis do krwiobiegu w celu wywołania bakteriemii i ostrych przypadków sepsy., Odporność gospodarza przed zakażeniami septycznymi w dużym stopniu zależy od neutrofili, dopełniacza, a także aktywacji PRRs, w tym receptorów sprzężonych z białkiem G (GPCRs), takich jak TLR2 (zielony) i fpr2 (niebieski). Infekcje związane z biofilmem na implantach medycznych pochodzą z zanieczyszczeń podczas wkładania urządzenia lub, w rzadkich przypadkach, z krwiobiegu. Pacjenci z implantami medycznymi są podatni na sepsę S. epidermidis, ponieważ bakterie biofilmu mogą często rozprzestrzeniać się do krwiobiegu., Uważa się, że odpowiedź immunologiczna na infekcje związane z biofilmem nie jest skuteczna, ponieważ biofilmy hamują zabijanie fagocytarne przez PMN i makrofagi. Ponadto zaburzają układ odpornościowy w kierunku zwiększonej produkcji cytokin przeciwzapalnych, takich jak IL-13, ograniczając jednocześnie wydzielanie cytokin prozapalnych, w tym IL1-beta, IL-12 i IFN-gamma.
rola dopełniacza w zakażeniach związanych z zakażeniem jest dość niejasna. While S., szczepy produkujące biofilm naskórkowy wywołują silniejszą reakcję w aktywacji i uwalnianiu składników dopełniacza niż ich izogenne Pia-ujemne, a tym samym biofilm-ujemne odpowiedniki (Kristian et al., 2008; Fredheim et al., 2011), takie wydanie dopełniacza nie przekładało się na wzmożone zabijanie fagocytarne. S. epidermidis Pia-dodatnie biofilmy wyzwalane uwalnianie C3A, ale chroniły S. epidermidis od opsonizacji C3b i IgG i zabijania za pośrednictwem PMN (Kristian et al., 2008)., Szczególnie—podczas gdy niektórzy autorzy próbowali przypisać specyficzne efekty Pia, a nie Tworzenie biofilmu, przez mechaniczne niszczenie agregatów (Vuong et al., 2004), w żadnym z tych badań nie można dokonać wyraźnego rozróżnienia między działaniem aglomeracji biofilmu a bezpośrednim działaniem egzopolisacharydu PIA. Jeśli chodzi o Deklarowane właściwości prozapalne PIA (Kristian et al., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), fakt, że PIA jest substancją trudną do oczyszczenia i izogeniczne mutanty Pia-ujemne mają wyraźnie różne właściwości powierzchni komórek, utrudnia przypisanie obserwowanych efektów bezpośrednio cząsteczce PIA.
odnotowano, że szczepy hodowane w biofilmie S. epidermidis wywołują produkcję cytokin przeciwzapalnych, a nie prozapalnych (Spiliopoulou et al., 2012). W odpowiednim badaniu pierwotne makrofagi pochodzące z monocytów ludzkich stymulowane były żywym S., naskórek z biofilmów 24-godzinnych wytwarzał niższy poziom cytokin prozapalnych (IL-1BETA, IFN-gamma, IL-12) i podwyższony poziom cytokin przeciwzapalnych IL-13 niż komórki planktoniczne uprawiane przez 2 h. oczywiście w tym porównaniu inne czynniki, takie jak przede wszystkim regulowane kworum czynniki prozapalne, takie jak rozpuszczalne w fenolu moduliny (PSMs) (Cheung et al., 2014) omówione poniżej, mogą być odpowiedzialne za obserwowane różnice, a nie za samą formację biofilmu., Jednak porównując biofilm dodatni z izogenicznymi szczepami biofilmu ujemnego (Pia-ujemny, Embp lub Aap-ujemny), Schommer et al. zaobserwowano również zmniejszoną odpowiedź zapalną w makrofagach 774A.1 ze zmniejszoną aktywacją NF-kappaB i zmniejszoną produkcją IL-1BETA (Schommer et al., 2011).
niewiele wiadomo o tym, jak adaptacyjny układ odpornościowy reaguje na infekcje związane z biofilmem, częściowo, ponieważ trudno jest ustalić długoterminowe modele infekcji biofilmem S. epidermidis. Vuong et al. opracowali model zakażenia mysiego związany z cewnikiem z S., bioluminescencyjny szczep epidermidis o nazwie SE Xen43, dzięki któremu byli w stanie monitorować w czasie rzeczywistym postęp zakażenia związanego z biofilmem S. epidermidis (Vuong et al., 2008). Porównując wrażliwość Nu / Nu (z niedoborem komórek T) i CBSCBG-MM (z niedoborem komórek T / B) na zakażenie związane z biofilmem S. epidermidis z Immuno-kompetentnymi dzikimi myszami Balb/C, autorzy stwierdzili, że w szczególności myszy Nu/Nu były bardziej podatne na zakażenie, co wskazuje na ważną rolę odporności komórek T przeciwko zakażeniom związanym z biofilmem S. epidermidis.
Odporność Na S., epidermidis podczas sepsy
obecność CoNS we krwi (bakteremia), często pochodzące z rozprzestrzeniania się bakterii z biofilmów na zamieszkujących urządzenia medyczne, może powodować ostrą sepsę (ryc. 2). Wady bakteriemii wiążą się ze znacznymi kosztami opieki zdrowotnej, zachorowalnością i śmiertelnością (Bearman and Wenzel, 2005). Noworodki z upośledzoną odpornością i przedwcześnie urodzone są najbardziej narażone na sepsę, A S. epidermidis jest najbardziej rozpowszechnionym gatunkiem biorącym udział w zakażeniach (Cheung and Otto, 2010).
w przeciwieństwie do zakażeń wywołanych przez S. epidermidis, które są przewlekłe, S., sepsa naskórka jest ostra z natury. Dlatego odpowiedź immunologiczna gospodarza na sepsę S. epidermidis, która odbywa się głównie w krwiobiegu, jest zupełnie inna niż w przypadku zakażeń biofilmu S. epidermidis zamieszkujących tkanki. Ponieważ noworodki mają zwiększoną podatność na sepsę S. epidermidis, większość badań na ten temat dotyczyła sepsy noworodków S. epidermidis. W związku z tym poniższa dyskusja będzie poświęcona odporności noworodków w odpowiedzi na sepsę S. epidermidis.,
ważnym elementem wrodzonej odpowiedzi immunologicznej są wrodzone komórki odpornościowe, wśród których dominują neutrofile. Neutrofile rozpoznają inwazyjne drobnoustroje poprzez repertuar receptorów gospodarza (patrz poniżej), spożywają je i eliminują je w fagosomie przez reaktywne formy tlenu i białka przeciwbakteryjne uwalniane podczas procesu zwanego degranulacją (Malech et al., 2014). Ponadto, lysed neutrofile mogą tworzyć neutrofile pozakomórkowe pułapki (sieci) do wiązania i zabijania inwazyjnych drobnoustrojów (Brinkmann et al., 2004).,
kilka receptorów rozpoznawania wzorców (PRRs), które rozpoznają i wiążą konserwowanych produktów drobnoustrojów (PAMPs, patogen związane wzorce molekularne) i odgrywają istotną rolę w aktywacji wrodzonej odpowiedzi immunologicznej, okazały się być krytyczne w odporności gospodarza przeciwko S. epidermidis sepsis. Wykazano, że TLR2 ma krytyczne znaczenie dla klirensu S. epidermidis w modelu posocznicy u myszy (Strunk et al., 2010). U ludzkich noworodków występuje wzrost ekspresji TLR2 w przebiegu sepsy S. epidermidis (Viemann et al.,, 2005), jednak układ odpornościowy stymulowany TLR był mniej biegły w wywoływaniu wielu odpowiedzi cytokin u noworodków w porównaniu do dorosłych (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001), oraz kwas lipoteichoic (LTA) (Xia et al., 2016) zostały uznane za efektory TLR2. Jednak badania z PIA i PSMs nie zostały zweryfikowane z mutantami izogennymi; a jeśli chodzi o LTA, istnieją ostatnie dowody wskazujące, że gronkowcowe lipopeptydy, a nie LTA, są prawdziwymi czynnikami stymulującymi odporność (Hashimoto et al., 2006)., Ponadto w S. aureus wykazano, że PSM nie są bezpośrednimi agonistami TLR2, ale prowadzą do uwalniania lipopeptydów z powierzchni komórki, a tym samym mają wtórny efekt stymulujący TLR2 (Hanzelmann et al., 2016), efekt prawdopodobnie obecny także u S. epidermidis.
w oparciu o fakt, że receptor peptydu formylowego 2 (FPR2) rozpoznaje PSMs (Kretschmer et al., 2010), ten sprzężony z białkiem G receptor chemoattractant jest kolejnym potencjalnie ważnym receptorem gospodarza w odpowiedzi na S. epidermidis. Jak pokazano w S., aureus, aktywacja PSM-FPR2 indukuje chemotaksję, egzocytozę granulek i uwalnianie interleukiny-8 (IL-8) z PMNs (Wang et al., 2007; Kretschmer i in., 2010). Badania nad wpływem PSMs Min na odpowiedź immunologiczną przeprowadzono tylko z czystymi PSMs S. epidermidis (Cheung et al., 2010), a do tej pory były utrudnione przez mnogość genetycznych loci psm u S. epidermidis i ogólne trudności w wytwarzaniu mutantów delecji izogenicznej u CoNS. Jednak ostatnie badania przypisały kluczową rolę mobilnemu kodowanemu na elemencie genetycznym, wysoko produkowanemu PSM-mec z S., naskórka w stanach zapalnych i immunologicznych, przy użyciu izogennych mutantów psm-mec (Qin i in., 2017).
dopełniacz odgrywa również ważną rolę w odporności na sepsę S. epidermidis. Niedobory czynnika dopełniacza C3 i IgG są związane z większym ryzykiem wystąpienia sepsy związanej z wadami noworodków (Lassiter et al., 1991). Ponadto, w badaniu z wykorzystaniem modelu sepsy pełnej krwi ex vivo, S. epidermidis wywołał znacznie mniejszą aktywację dopełniacza u noworodków w porównaniu do krwi dorosłych (Granslo et al., 2013)., To odkrycie sugeruje, że istnieje niedobór dojrzałości w układzie dopełniacza noworodków, co częściowo może wyjaśniać, dlaczego noworodki są bardziej podatne na zakażenia septyczne S. epidermidis niż dorośli. Ponadto w badaniu podkreślono znaczenie układu dopełniacza w obronie gospodarza przed sepsą S. epidermidis.
podobnie jak dopełniacz, neutrofile wcześniaków wykazują niedobór dojrzałości. Wykazują one upośledzony wybuch oksydacyjny w porównaniu do tych izolowanych od noworodków terminowych, gdy stymulowane S. epidermidis (Björkqvist et al., 2004)., To, w części, może również wyjaśniać zwiększoną podatność u noworodków przedwcześnie urodzonych na S. epidermidis sepsa. Co ciekawe, monocyty, inny składnik komórkowy w wrodzonej odpowiedzi immunologicznej, nie są niezbędne do obrony gospodarza przed sepsą noworodków S. epidermidis, ponieważ zarówno ludzkie noworodki, jak i dorosłe monocyty wykazywały podobną zdolność do zabijania fagocytarnego i wewnątrzkomórkowego (Strunk et al., 2007). Łącznie wskazuje to, że neutrofile odgrywają szczególnie ważną rolę w odpowiedzi immunologicznej podczas sepsy S. epidermidis.,
chociaż istnieją liczne badania poświęcone zrozumieniu roli wrodzonej odpowiedzi immunologicznej podczas sepsy S. epidermidis, badania nad rolą adaptacyjnej odpowiedzi immunologicznej w zakażeniach septycznych S. epidermidis pozostają ograniczone. Ponieważ infekcje te mają charakter ostry, jest mało prawdopodobne, że adaptacyjna odpowiedź immunologiczna odgrywa znaczącą rolę. W związku z tym dożylne transfer immunoglobuliny od dawców o wysokich mianach przeciwciał przeciwko S. epidermidis lub S. aureus nie udało się chronić przed posocznicą u wcześniaków (Bloom et al., 2005; DeJonge et al., 2007).,
wnioski
infekcje kons, a w szczególności S. epidermidis, stanowią znaczne obciążenie medyczne i ekonomiczne dla publicznej opieki zdrowotnej. Ponadto, wraz z pojawieniem się oporności na antybiotyki, możliwości leczenia stają się ograniczone. Eliminacja bakterii S. epidermidis wydaje się jednak nieodpowiednia, ponieważ są one integralną częścią korzystnej mikrobioty na skórze i błonach śluzowych.
korzystna rola S., kolonizacja naskórka w zapobieganiu przerostowi patogenów na skórze, w oparciu o wyniki u myszy, przypisuje się stymulacji odpowiedzi immunologicznej. Jednak ze względu na to, że model skóry myszy ledwo odzwierciedla sytuację na ludzkiej skórze, pozostaje słabo zrozumiałe, czy wyniki można przenieść na ludzi. Ponadto, czy istnieje rola potencjalnych bezpośrednich interakcji bakteryjnych między S. epidermidis i patogenów na skórze pozostaje do zbadania.
odpowiedź immunologiczna na S. epidermidis podczas infekcji jest prawdopodobnie jeszcze mniej poznana., W przewlekłym zakażeniu związanym z biofilmem trudno jest odróżnić efekty aglomeracji ścinającej od tych, w których pośredniczy określone składniki powierzchni komórek. Podczas sepsy charakter i rola cytokin prozapalnych i dróg zapalnych w odpowiedzi na S. epidermidis pozostaje równie słabo zdefiniowana. Wyjaśnienie tych mechanizmów dostarczy również więcej informacji na temat tego, dlaczego noworodki są szczególnie podatne na zakażenie S. epidermidis. Poczyniono postępy w zakresie narzędzi biologii molekularnej dla S., naskórek i wady w ogóle będą bardzo pomocne w tych przedsięwzięciach, a zwłaszcza pomóc w rozróżnieniu między bezpośredni i wtórnych efektów. Oczywiście głębsze zrozumienie odpowiedzi immunologicznej gospodarza na te infekcje będzie kluczowe dla rozwoju szczepionek S. epidermidis i nowych terapii.
wkład autora
TN i MO napisali manuskrypt. MP i TN przygotowały dane.,
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
badanie to było wspierane przez Intramural Research Program National Institute of Allergy and Infectious Diseases (NIAID), U. S. National Institutes of Health (NIH), numer projektu Zia AI001080.
Kloos, W. E., and Musselwhite, M. S. (1975)., Rozmieszczenie i utrzymywanie się szczepów Staphylococcus i Micrococcus oraz innych bakterii tlenowych na skórze człowieka. Appl. Mikrobiol. 30, 381–385.
PubMed Abstract | Google Scholar















