budulcem białek są aminokwasy, które są małymi cząsteczkami organicznymi, które składają się z alfa (centralnego) atomu węgla połączonego z grupą aminową, grupą karboksylową, atomem wodoru i zmiennym składnikiem zwanym łańcuchem bocznym (patrz niżej). W białku wiele aminokwasów jest połączonych ze sobą wiązaniami peptydowymi, tworząc w ten sposób długi łańcuch., Wiązania peptydowe są tworzone przez reakcję biochemiczną, która ekstrahuje cząsteczkę wody, ponieważ łączy grupę aminową jednego aminokwasu z grupą karboksylową sąsiedniego aminokwasu. Liniowa sekwencja aminokwasów w białku jest uważana za podstawową strukturę białka.
białka zbudowane są z zestawu zaledwie dwudziestu aminokwasów, z których każdy ma unikalny łańcuch boczny. Łańcuchy boczne aminokwasów mają różne chemikalia. Największa grupa aminokwasów ma niepolarne łańcuchy boczne., Kilka innych aminokwasów ma łańcuchy boczne z dodatnimi lub ujemnymi ładunkami, podczas gdy inne mają polarne, ale nie naładowane łańcuchy boczne. Chemia aminokwasów łańcuchów bocznych jest krytyczna dla struktury białka, ponieważ te łańcuchy boczne mogą wiązać się ze sobą, aby utrzymać długość białka w pewnym kształcie lub konformacji. Naładowane łańcuchy boczne aminokwasów mogą tworzyć wiązania jonowe, a aminokwasy polarne są zdolne do tworzenia wiązań wodorowych. Hydrofobowe łańcuchy boczne oddziałują ze sobą poprzez słabe oddziaływania van der Waalsa. Zdecydowana większość wiązań utworzonych przez te łańcuchy boczne jest nienowartościowa., W rzeczywistości cysteiny są jedynymi aminokwasami zdolnymi do tworzenia wiązań kowalencyjnych, co robią ze swoimi szczególnymi łańcuchami bocznymi. Ze względu na interakcje łańcucha bocznego, kolejność i położenie aminokwasów w danym białku, w których występują zagięcia i fałdy w tym białku (ryc. 1).,
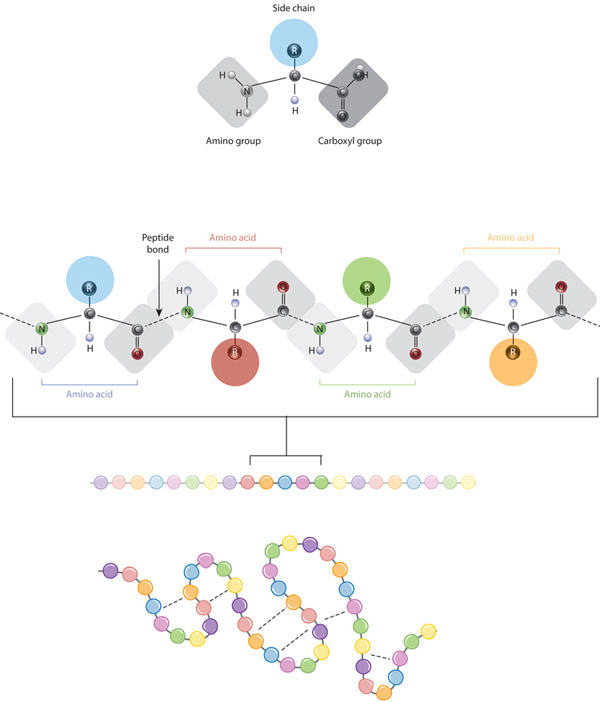
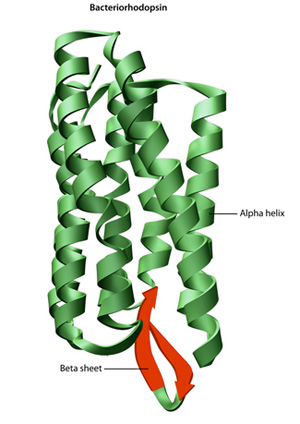
pierwotnej struktury białka jego sekwencji aminokwasowej-dyski składane i wewnątrzcząsteczkowego wiązania liniowego łańcucha aminokwasowego, który ostatecznie określa unikalny trójwymiarowy kształt białka . Wiązanie wodorowe między grupami aminowymi i grupami karboksylowymi w sąsiednich regionach łańcucha białkowego czasami powoduje występowanie pewnych wzorców fałdowania., Znane jako helisy alfa i arkusze beta, te stabilne wzory składania tworzą drugorzędną strukturę białka. Większość białek zawiera wiele Helis i arkuszy, oprócz innych mniej powszechnych wzorów (Rysunek 2). Zespół formacji i fałd w jednym liniowym łańcuchu aminokwasów – czasami nazywany polipeptydem-stanowi trzeciorzędową strukturę białka. Wreszcie, czwartorzędowa struktura białka odnosi się do tych makrocząsteczek z wieloma łańcuchami polipeptydowymi lub podjednostkami.,
ostateczny kształt przyjęty przez nowo zsyntetyzowane białko jest zazwyczaj najbardziej energetycznie korzystny. Gdy białka się składają, testują różne konformacje przed osiągnięciem ich ostatecznej formy, która jest unikalna i zwarta. Złożone białka są stabilizowane przez tysiące nienowartościowych wiązań między aminokwasami. Ponadto siły chemiczne pomiędzy białkiem a jego najbliższym otoczeniem przyczyniają się do kształtu i stabilności białka., Na przykład, białka, które są rozpuszczone w cytoplazmie komórkowej mają hydrofilowe (kochające wodę) grupy chemiczne na ich powierzchniach, podczas gdy ich hydrofobowe (przeciwne wodzie) elementy mają tendencję do schowania się wewnątrz. W przeciwieństwie do tego, białka, które są wprowadzane do błon komórkowych, wykazują pewne hydrofobowe grupy chemiczne na ich powierzchni, szczególnie w tych regionach, w których powierzchnia białka jest narażona na lipidy błonowe. Ważne jest jednak, aby pamiętać, że w pełni złożone białka nie są zamrożone do kształtu. Zamiast tego Atomy tych białek pozostają zdolne do wykonywania niewielkich ruchów.,
mimo że białka są uważane za makrocząsteczki, są zbyt małe, aby je wizualizować, nawet za pomocą mikroskopu. Naukowcy muszą więc użyć pośrednich metod, aby dowiedzieć się, jak wyglądają i jak są składane. Najczęstszą metodą stosowaną do badania struktur białkowych jest krystalografia rentgenowska. Dzięki tej metodzie stałe kryształy oczyszczonego białka są umieszczane w wiązce promieniowania rentgenowskiego, a wzór odchylonych promieni X jest używany do przewidywania pozycji tysięcy atomów w krysztale białka.















