rakennuspalikoita proteiinit ovat aminohappoja, jotka ovat pieniä orgaanisia molekyylejä, jotka koostuvat alfa – (keski -) hiiliatomi liittyy aminoryhmä, karboksyyliryhmän, vetyatomi, ja muuttuva tekijä nimeltään puolella ketju (ks.alla). Proteiinin sisällä useat aminohapot liittyvät toisiinsa peptidisidoksilla, jolloin muodostuu pitkä ketju., Peptidi joukkovelkakirjoja muodostetaan biokemiallinen reaktio, joka poimii veden molekyyli, koska se liittyy aminoryhmä yksi aminohappo karboksyyliryhmän naapurimaiden aminohappo. Proteiinin perusrakenteena pidetään aminohappojen lineaarista sekvenssiä proteiinin sisällä.
proteiinit rakentuvat vain kahdestakymmenestä aminohaposta, joista jokaisella on ainutlaatuinen sivuketju. Aminohappojen sivuketjuissa on erilaisia kemistejä. Suurimmassa aminohapporyhmässä on ei-polaarisia sivuketjuja., Useissa muissa aminohapoissa on sivuketjuja, joissa on positiivisia tai negatiivisia varauksia, kun taas toisissa on polaarisia mutta kartoittamattomia sivuketjuja. Kemia aminohappo puolella ketjut on kriittinen proteiini rakenne, koska nämä puolella ketjut voivat sitoutua toisiinsa järjestää pituus proteiinia tietty muoto tai rakenne. Varatut aminohapon sivuketjut voivat muodostaa ionisidoksia, ja polaariset aminohapot pystyvät muodostamaan vetysidoksia. Hydrofobiset sivuketjut vuorovaikuttavat keskenään heikkojen van der Waalsin vuorovaikutusten kautta. Valtaosa näiden sivuketjujen muodostamista sidoksista on nonkovalentteja., Kysteiinit ovat itse asiassa ainoat aminohapot, jotka kykenevät muodostamaan kovalenttisia sidoksia, joita ne tekevät tietyillä sivuketjuillaan. Sivuketjuvuorovaikutusten vuoksi aminohappojen järjestys ja sijainti tietyssä proteiinissa ohjaa, missä mutkat ja poimut tapahtuvat kyseisessä proteiinissa (Kuva 1).,
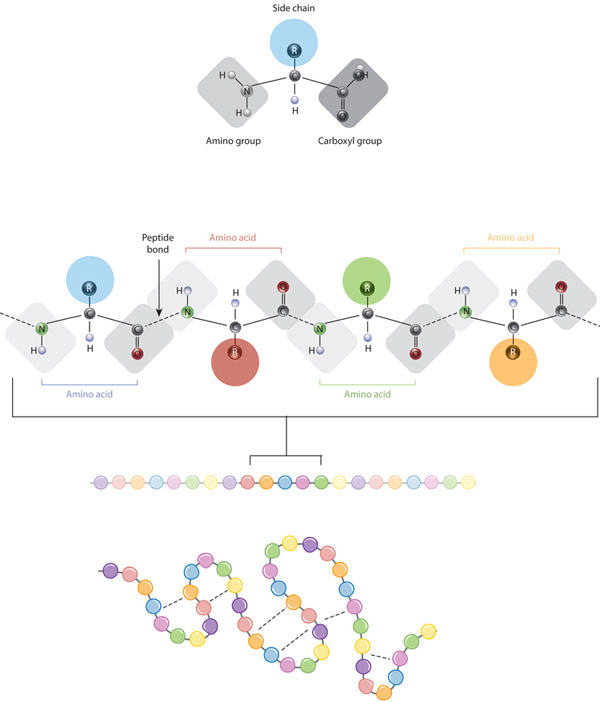
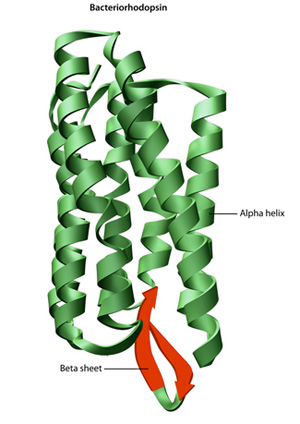
kantavaan rakenteeseen proteiini — sen aminohappojärjestys — asemat taitto ja intramolekulaarisen liimaus lineaarinen aminohapon ketju, joka lopulta määrää proteiinia on ainutlaatuinen kolmiulotteinen muoto. Vety liimaus välillä amino-ryhmien ja karboksyyliryhmiä lähialueilla proteiinin ketju joskus aiheuttaa tiettyjä malleja, taitto tapahtuu., Tunnetaan alfa helices ja beta-levyt, nämä stabiilit taitto kuvioita muodostavat toissijaisen rakenteen proteiinin. Useimmissa proteiineissa on muiden harvinaisempien kuvioiden lisäksi useita kierteitä ja arkkia (kuva 2). Kokonaisuus muodostumat ja taittuu yhden lineaarinen ketju aminohappoja — joskus kutsutaan polypeptidi — on korkea-asteen rakenne proteiinia. Lopuksi proteiinin kvaternaarinen rakenne viittaa niihin makromolekyyleihin, joilla on useita polypeptidiketjuja tai alayksiköitä.,
vasta syntetisoidun proteiinin omaksuma lopullinen muoto on tyypillisesti energeettisesti edullisin. Kuten proteiineja kertaiseksi, he testaavat erilaisia conformations, ennen niiden lopullista muotoa, joka on ainutlaatuinen ja kompakti. Taiteltuja proteiineja stabiloivat tuhannet aminohappojen väliset ei-kovalenttiset sidokset. Lisäksi proteiinin ja sen lähiympäristön väliset kemialliset voimat edistävät proteiinin muotoa ja stabiilisuutta., Esimerkiksi, proteiineja, jotka ovat liuenneet solun sytoplasmassa on hydrofiilinen (vettä rakastava) kemiallisia ryhmiä, niiden pinnoille, ottaa huomioon, että niiden hydrofobinen (vettä kaihtava) tekijät ovat yleensä piilossa sisällä. Sen sijaan proteiineja, jotka työnnetään solukalvojen näyttää joitakin hydrofobinen kemiallisia ryhmiä, niiden pinnalla, erityisesti niillä alueilla, joilla proteiinin pinta on alttiina kalvolla lipidien. On kuitenkin tärkeää huomata, että täysin Taitetut proteiinit eivät jäädy muotoon. Sen sijaan näiden proteiinien atomit pystyvät edelleen tekemään pieniä liikkeitä.,
vaikka proteiineja pidetään makromolekyyleistä, ne ovat liian pieniä visualisoida, jopa mikroskoopilla. Tutkijoiden on siis käytettävä epäsuoria menetelmiä selvittääkseen, miltä ne näyttävät ja miten ne taitetaan. Yleisin proteiinirakenteiden tutkimiseen käytetty menetelmä on röntgenkristallografia. Tällä menetelmällä, kiinteitä kiteitä puhdistettua proteiinia sijoitetaan X-ray palkki, ja kuvio taipua X-säteet käytetään ennustaa kantojen tuhansien atomien sisällä proteiinia kristalli.















