Johdanto
Koagulaasi-negatiiviset stafylokokit (CoNS) ovat heterogeeninen ryhmä stafylokokki laji luokitellaan kliinisesti puuttuminen veren hyytymistä entsyymi koagulaasi. Tämä erottaa heidät Staphylococcus aureuksesta ja muutamasta kliinisesti vähemmän tärkeästä koagulaasipositiivisesta lajista., Tänään, Haitat ovat yleisimmin eristetyt bakteerit kliinisissä kulttuureissa ja on syntynyt merkittäviä sairaalainfektioiden taudinaiheuttajia. Riskitekijöitä Miinukset infektio ovat läsnäolo sisimmässä lääketieteelliset implantit, kuten suonensisäinen katetri, tai immunosuppressio, koska syöpä tai HIV/AIDS. CoNS-infektioiden hoitoa vaikeuttaa antibioottiresistenttien kantojen (kuten erityisesti MRSE, metisilliiniresistentti S. epidermidis) ilmaantuminen (Rogers et al., 2009).,
CoNS on olennainen osa ihmisen ihon ja limakalvojen normaalia kasvistoa ja asuttaa mieluummin kosteat alueet (Grice et al., 2009). S. epidermidis, yleisimpiä Haittoja lajien toipunut kliinisen kulttuureissa, colonizes kainalo, nivus, anterior nares, sidekalvon, toe hihnat, ja välilihan alue (Kloos ja Musselwhite, 1975). Vaikka yleensä harmittomia tai jopa hyödyllisiä siirtomaavallat, kun isäntä epiteelin este on heikentynyt, Huonoja puolia, kuten S. epidermidis voi aiheuttaa vakavia infektioita., Itse asiassa, Miinukset infektiot muodostavat suurimman bakteeri sepsis ja roskan-liittyvät infektiot, S. epidermidis on merkittävin lajien osalta (Rogers et al., 2009).
isännän immuunivastetta S. epidermidis, mekanismi immuuni toleranssi, ja immuunijärjestelmän etuja, että S. epidermidis commensals voi tarjota, ovat juuri alkaneet purkaa. Tämä tarkastelu antaa uusimman tutkimuksen host response S. epidermidis kuin commensals, ja opportunistinen bakteereja yhteydessä biofilmin ja septinen infektiot.,
Isännän Immuunivastetta S. epidermidis kuin Commensal
on yhä enemmän näyttöä siitä, että ihon mikrobiston yleensä on merkittävä vaikutus immuunijärjestelmään (Belkaid ja Tamoutounour, 2016). Vaikka Huonot on yksi tärkeimmistä ihon siirtomaavallat, erityisiä tutkimuksia isännän immuunivastetta Miinukset kolonisaatio ja perustaminen on ollut vähäistä. Ne, jotka ovat käytettävissä ovat keskittyneet immuunivastetta ihon kolonisaatiota tyypillisten Miinukset lajia S. epidermidis ja hyötyjä, kuten kolonisaatio tarjoaa isäntä.,
esimerkiksi Gallo-ryhmä on kuvattu mahdollisesti hyödyllisiä toimintoja, S. epidermidis, kuten ihon commensal. Nimittäin, Lai et al. raportoitu, että S. epidermidis lipoteichoic acid (LTA) kautta mekanismi, johon liittyy TLR (toll-like receptor) 2 vähentää ihotulehdusta (Lai et al., 2009). Samat kirjoittajat kertoivat myöhemmin myös, että S., epidermidis (mutta ei muita bakteereja) tuottaa ei vielä tunnettu aine alle 10 kD, joka aktivoi TLR2, ja siten indusoi antimikrobinen peptidi tuotantoa, mikä lisäsi kapasiteettia solujen lysaatit estää kasvua ryhmän Streptokokki ja S. aureus (Lai et al., 2010) (kuva 1a). Vaikka nämä tulokset korostavat S: N hyödyllistä tehtävää., epidermidis iholla, jotka koskevat stimuloiva tekijä, ne on nähtävä siinä valossa, että usein raportoitu aktivointi TLR2, jonka LTA on kyseenalaistettu: LTA puhdistaminen on erittäin vaikeaa ja usein sisältää TLR2-stimuloiva syntetisoitu epäpuhtauksia, mukaan lukien kaupalliset valmisteet (Hashimoto et al., 2006). Nämä löydökset vaativat siis varmasti lisäarviointia käyttämällä S. epidermidis-bakteerin isogeenisiä mutantteja stimuloivan tekijän luonteen todentamiseksi.
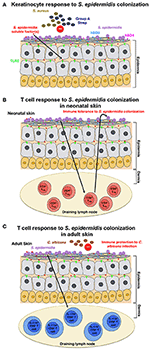
Kuva 1., Malli host response S. epidermidis kolonisaatio (A) S. epidermidis colonizes ihon orvaskeden, erittäin järjestäytynyt rakenne, joka koostuu pääosin keratinosyyteistä. Vastauksena S. epidermidis kolonisaatio, hahmontunnistus reseptoreihin (PRRs), kuten TLR2 on keratinosyyttien sitoutuvat huonosti tunnettu tekijä(t) erittyy S. epidermidis edistää signalointi cascade, että tulokset, esimerkiksi tuotannossa antimikrobisten peptidien β-defensin 2 (hBD2) ja hBD3. Nämä antimikrobiset peptidit suojaavat ihon S. aureus-ja A-ryhmän streptokokki-infektioilta., (B) S. epidermidis asuttaminen aiheuttaa tietyn CD4+ FOXP3+ Treg vastaus, joka on välttämätön immuunijärjestelmän toleranssi kohti S. epidermidis kuin commensal. Immuuni toleranssi uskotaan olevan perustettu vain vastasyntyneisyyskaudella, kuten kolonisaatio aikuisilla hiirillä ei luoda suvaitsevaisuutta. (C) eri mallia, joka perustuu saatujen tulosten aikuisilla hiirillä, ihon kolonisaatiota S. epidermidis laukaisee tietyn IL-17A+ CD8+ T-solujen vastaus., Pohjamaalattu ihon tyhjennys imusolmuke, jonka CD103+ dendritic soluja, nämä T-solut parantaa luontaisen mikrobilääkkeiden puolustus ja estää hyökkäys sieni, C. albicans.
Scharschmidt et al. osoitti, että kolonisaatio S. epidermidis laukaisi paikallisia sekä systeemisiä, erityisiä CD4+ – T-solujen vastaus on osoituksena se, että rikastuminen erityisiä CD4+ – T-soluja sekä ihon-tyhjennys imusolmukkeiden ja pernan (Scharschmidt et al., 2015). Tämä ryhmä suunnitteli S., epidermidis iho eristää, kanta Tü3298, ilmaista peptidi-antigeeni 2W (Epi-2W) liittyy fluoresoiva proteiini. Saavuttaa kolonisaatio, ne levitetään 108-109 Cfu suunniteltu Epi-2W rasitusta selän ihon C57BL/6 hiiriä 3 päivän välein yhteensä kolme hakemusta. Käyttämällä tätä malli, kirjoittajat osoitti, että laajentaminen erityisesti CD4+ – sääntely-T (Treg-solut) on tärkeä rooli immuunijärjestelmän toleranssi S. epidermidis., Tällainen toleranssi vaati kuitenkin varhaista bakteerien kolonisaatiota vastasyntyneen vaiheen aikana, sillä täysikasvuisten hiirten kolonisaatio ei osoittanut siedettävyyttä (Kuva 1b). The work by Scharschmidt et al. on erityisen kiehtova, koska se tarjoaa tieteellisiä perusteita mukauttaminen ihon mikrobiston vastasyntyneisyyskaudella hoitovaihtoehtona hoitoon tulehduksellinen ihon sairaudet, ja erityisesti atooppinen ihottuma (AD).
AD-potilaiden ihon kolonisoi usein S. aureus (Higaki et al., 1999). Useat tutkimukset osoittavat, että S., epidermidis on toiseksi yleisin mikrobi eristetty AD-vaikuttaa ihon vaurioita (Hon ym., 2005, 2012, 2016). Vaikka tämä ei suoraan syytetä S. epidermidis synnyssä AD, koska sen normaali ja usein runsaasti iholla, viimeisin näistä tutkimuksista, Kulta et al. tutkittava bakteeri-isolaatteja, 100 AD-potilaiden ja todettiin, että S. epidermidis on läsnä kaikkein vakavasti AD-vaikuttaa ihon vaurioita (Hon ym., 2016). Näin S. epidermidiksen ja S. aureuksen (Cogen et al., 2010; Iwase ym.,, 2010), ei kääntänyt vähemmän sairauksia tutkimuksessaan. Sen sijaan tulokset viittasivat siihen, että S. epidermidis-kolonisaatioon liittyy vakavampi AD-tauti. Varmasti, lisätutkimuksia tarvitaan, arvioida roolia S. epidermidis AD synnyssä ja luonnon välisen suhteen S. aureus ja S. epidermidis AD vaurioita.
Naik et al. on osoitettu, että S. epidermidis-kolonisaatio aikuisilla hiirillä saa aikaan ihon spesifisen T-soluvasteen (Naik et al., 2015). Tässä tutkimuksessa ryhmä käytti ~5 ml 107-109 PMY / ml S., epidermidis koko hiiren ihon pinnalle joka toinen päivä, yhteensä neljä hakemusta, menettely, jolla ne ilmoitetaan saada vakaa kolonisaatio. Tässä tutkimuksessa indusoidut T-solut olivat kuitenkin IL-17a+ CD8+ T-soluja CD4+ T-solujen sijaan, kuten Scharschmidt ym. tutkimus (Scharschmidt ym., 2015). Kirjoittajat osoittivat, että nämä IL-17A+ CD8+ T-solujen immuniteetti ihon C. albicans-infektio (Kuva 1C); kuitenkin, ne eivät ole tutkia, onko tämä myös antaa immuniteetin muita taudinaiheuttajia, erityisesti S. aureus (Naik et al., 2015).,
Sekä Scharschmidt et al. ja Naik et al. tutkimuksissa tutkittiin isännän immuunivastetta S. epidermidis-kolonisaatiolle, mutta niiden löydökset ovat aivan erilaisia. Nämä erot voivat johtua vivahteita setup hiiren mallit tai mahdollisesti myös erityisiä S. epidermidis-kantoja käytetään. Eroista huolimatta tulokset, yhdessä, kaksi tutkimukset osoittivat, että kolonisaatio S. epidermidis aiheuttaa mukautuva T-solujen vastaus hiirillä. On kuitenkin epäselvää, onko S. epidermidis-kolonisaation aiheuttama immuunijälki havaittavissa myös ihmisillä.,
Immuniteetin S. epidermidis Biofilm-Liittyvät Infektiot
Hyvin harvat tutkimukset on tehty, arvioida immuunivastetta Miinukset biofilm-liittyvät infektiot, erityisesti verrattuna S. aureus. Useimmat näistä tutkimuksista ovat keskittyneet S. epidermidis. Miinukset biofilm liittyviä infektioita esiintyy usein potilailla, joilla on lääketieteellisiä implantteja, S. epidermidis on todennäköisesti lajien talteen (Rogers et al., 2009)., Biokalvot ovat monimutkaisia, tilallisesti monipuolinen taajamissa bakteerisolujen sisälle amorfinen, itse tuotettu soluväliaineen koostuu solun DNA: ta, proteiineja ja polysakkarideja (Otto, 2008). Biofilmin liittyvät infektiot ovat erittäin kestävä antibioottihoito useista syistä, mukaan lukien vähentää aineenvaihduntaa ja haitannut läpi tunkeutuminen soluväliaineen (Myyntiluvan haltija ja O ’ Toole, 2001). Näin ollen hoito vaatii usein tartunnan saaneen laitteen tai kudoksen kirurgista poistamista., Yhdysvalloissa yksin, noin 2 miljardia dollaria vuosittain käytetään hoitoon ja hallintaan ortopedisen implantin liittyvät infektiot (Darouiche, 2004; Parvizi ym., 2010).
yleensä, isännän immuunivastetta S. epidermidis biofilm-liittyvän infektion ei ole suojaava tai riittävän selkeä infektion. Siksi useimmat S. epidermidis biofilmiin liittyvät infektiot ovat kroonisia. Useimmat tähän mennessä aiheesta tehdyt tutkimukset ovat in vitro-tutkimuksia, joissa on verrattu biofilmikasvustoa planktonisiin bakteereihin. Useiden tutkimusten tulokset viittaavat siihen, että S., epidermidis biokalvot aiheuttaa vaimennus phagocytic toimintaa ja tuotanto anti-inflammatoristen sytokiinien, kun verrattuna heidän planktisten kollegansa (Kuva 2). S. epidermidis biofilmsin vaikutuksista fagosyyttiseen aktiivisuuteen on raportoitu ristiriitaisia havaintoja. Kaksi tutkimusta raportoi, että sitoutuminen ja fagosytoosin ihmisen neutrofiilien ja ensisijainen ihmisen monosyyteistä johdettujen makrofagit olivat huomattavasti parantaa, kun stimuloidaan biofilm-kasvaneet bakteerit (Heinzelmann et al., 1997; Spiliopoulou ym.,, 2012), kun taas toiset kertoivat, että biofilmin exopolysaccharide, polysakkaridi intercellular adhesiini (PIA) (Mack et al., 1996) on keskeinen rooli vaimennus phagocytic kapasiteetti hiiren vatsakalvon makrofagit (Shiau ja Wu 1998), J774A.1 hiiren makrofageja (Schommer ym., 2011), ja ihmisten pm. Kirjallisuudessa ollaan kuitenkin yksimielisiä S. epidermidis biofilmin vaikutuksista fagosyyttiseen tappamiseen. Ihmisen makrofagien tappaminen (Spiliopoulou et al., 2012) ja PMNs (Vuong et al., 2004; Kristian et al.,, 2008) sekä vasta-ainevälitteinen leukosyyttien tappaminen (Cerca et al., 2006) on voimakkaasti heikennetty biofilmikasvuisten bakteerien läsnä ollessa.
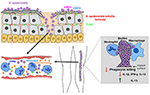
Kuva 2. S. epidermidis-infektioiden isäntävasteen malli. Rikkoo ihon läpi, seurauksena voi S. epidermidis levittämisestä verenkiertoon ja aiheuttaa verenmyrkytyksen ja akuuteissa tapauksissa verenmyrkytys., Isäntä immuniteetin septinen infektiot voimakkaasti riippuu siitä, neutrofiilien, täydentää, sekä aktivointi PRRs mukaan lukien G-proteiini-reseptoreihin (GPCRs), kuten TLR2 (vihreä) ja FPR2 (sininen). Biofilmiin liittyvät infektiot lääketieteellisissä implanteissa ovat peräisin kontaminaatioista laitteen asettamisen aikana tai harvinaisissa tapauksissa verenkierrosta. Potilaat, joilla on lääketieteellisiä implantteja, ovat alttiita S. epidermidis sepsis, sillä biofilmin bakteerit voivat usein levittää verenkiertoon., Immuunivastetta biofilm-liittyvät infektiot on yleensä ajateltu olevan ole tehokas, koska biokalvot estää fagosytoosin tappamiseen PMNs ja makrofagit. Lisäksi he vinossa immuunijärjestelmää kohti tehostettua tuotantoa anti-inflammatoristen sytokiinien, kuten IL-13 samalla rajoittaa eritystä pro-inflammatoristen sytokiinien, mukaan lukien IL1-beta, IL-12: n ja IFN-gamma.
rooli täydentää Miinukset biofilm-liittyvät infektiot on melko epäselvä. Kun Taas S., epidermidis biofilm tuottavia kantoja saada vahvempi vastauksen, aktivointi ja julkaisu komplementin komponentteja kuin niiden isogenic PIA-negatiivinen ja näin biofilm-negatiivinen kollegansa (Kristian et al., 2008; Fredheim ym., 2011), tällainen komplementtijulkaisu ei kääntänyt tehostettuun fagosyyttiseen tappamiseen. S. epidermidis PIA-positiivinen biokalvot laukaisi C3a julkaisu, mutta suojattu S. epidermidis alkaen C3b-ja IgG-opsonization ja PMN-välitteisen tappaminen (Kristian et al., 2008)., Erityisesti-vaikka jotkut kirjoittajat yrittivät määrittää erityisiä vaikutuksia PIA, sijaan biofilm muodostumista, mekaanisesti tuhoamalla aggregaatit(Vuong et al., 2004), yhdessäkään näistä tutkimuksista selkeän eron vaikutukset biofilm taajamissa ja suora vaikutus exopolysaccharide PIA voidaan tehdä. Mitä tulee väitettyihin Pia: n tulehdusominaisuuksiin (Kristian et al., 2008; Fredheim ym., 2011; Ferreirinha ym.,, 2016), tosiasiat, että PIA on vaikeaa-to-aine puhdistaa ja isogenic PIA-negatiivinen mutantit ovat selvästi eri solun pinnan ominaisuudet, on vaikea määrite havaittu vaikutuksia suoraan PIA molekyyli.
Se on raportoitu, että S. epidermidis biofilm-kasvanut kantoja saada tuotanto anti-inflammatorinen sijaan pro-inflammatoristen sytokiinien (Spiliopoulou et al., 2012). Kummankin tutkimuksen ensisijainen ihmisen monosyyteistä johdettujen makrofagit stimuloidaan live-S., epidermidis 24-h biokalvot tuotettu alhaisempi pro-inflammatoristen sytokiinien (IL-1beta, IFN-gamma, IL-12) ja kohonneet anti-inflammatorinen sytokiini IL-13 kuin planktisten soluja kasvatetaan 2 h. On selvää, että verrattuna muihin tekijöihin, kuten erityisesti päätösvaltaisuus-sensing-säänneltyjen pro-inflammatoriset tekijät, kuten fenoli-liukoinen modulins (PSMs) (Cheung et al., 2014) jäljempänä käsitelty voidaan saattaa vastuussa havaituista eroista eikä itse biofilmin muodostumisesta., Kuitenkin vertaamalla biofilm-positiivinen isogenic biofilm-negatiivinen (PIA-negatiivinen, Embp, tai Aap-negatiivinen) kantoja, Schommer ym. myös havaittu vähentää tulehdusreaktion 774A.1 makrofagien kanssa vähentää NF-kappaB aktivointi ja vähentää IL-1beta tuotanto (Schommer ym., 2011).
tiedetään Vähän siitä, kuinka mukautuva immuunijärjestelmä reagoi biofilm-liittyvät infektiot, osittain, koska se on vaikea luoda pitkän aikavälin S. epidermidis biofilm infektio malleja. Vuong ym. ovat kehittäneet katetriin liittyvän muriinitartuntamallin, jossa on S., epidermidis bioluminescent rasitusta kutsutaan SE Xen43, jonka avulla he pystyivät seuraamaan reaaliajassa etenemistä S. epidermidis biofilm-liittyvän infektion (Vuong et al., 2008). Vertaamalla alttiutta Nu/Nu (T-solu-puutteellinen) ja CBSCBG-MM (T/B-solu-puutteellinen) S. epidermidis biofilm-liittyvän infektion kanssa immuno-toimivaltaiset villi-tyyppi Balb/C hiirillä, tutkijat havaitsivat, että erityisesti Nu/Nu hiiret olivat enemmän alttiita tartunnalle, joka osoittaa tärkeä rooli T-soluvälitteisen immuniteetin S. epidermidis biofilm-liittyvän infektion.
immuniteetti S: ää vastaan., epidermidis aikana Sepsis
läsnäolo Miinukset veressä (bakteremia), usein peräisin leviämistä bakteerien biokalvot on sisimmässä lääkinnällisten laitteiden, voi aiheuttaa akuutti sepsis (Kuva 2). Conss bakteremia liittyy merkittäviin terveydenhuollon kustannuksiin, sairastuvuuteen ja kuolleisuuteen (Bearman ja Wenzel, 2005). Immuunijärjestelmän heikentynyt ja ennenaikaisia vastasyntyneitä ovat kaikkein alttiimpia Haitat sepsis S. epidermidis on yleisimpiä Haittoja lajien mukaan (Cheung ja Otto, 2010).
toisin kuin S. epidermidis biofilm-liittyvät infektiot, jotka ovat krooninen, S., epidermidis sepsis on luonteeltaan akuutti. Siksi isännän immuunivastetta S. epidermidis sepsis, joka tapahtuu pitkälti verenkiertoon, on aivan erilainen kuin vastaan kudos-kotipaikka S. epidermidis biofilm associated-infektioita. Koska vastasyntyneillä on lisääntynyt alttius S. epidermidis sepsis, useimmat tutkimukset asiasta käsitellä S. epidermidis vastasyntyneen sepsis. Siksi seuraavassa keskustelussa keskitytään vastasyntyneen immuniteettiin S. epidermidis sepsiksen vuoksi.,
tärkeä osa luontaisen immuunivasteen ovat luontainen immuunijärjestelmän soluja, joista neutrofiilit hallitsevat useita. Neutrofiilit tunnistavat hyökkääviä mikrobeja kautta ohjelmistoon host-reseptorit (ks. alla), nielemään niitä, ja poistaa ne sisällä phagosome reaktiivisia hapen lajeja ja antimikrobisia proteiineja vapautuu prosessia kutsutaan fagosytoosia (Mlynek et al., 2014). Lisäksi lysed neutrofiilit voivat muodostaa neutrofiilien solunulkoisia ansoja (verkkoja) sitomaan ja tappamaan tunkeutuvia mikrobeja (Brinkmann et al., 2004).,
Useita hahmontunnistus-reseptoreihin (PRRs), jotka tunnistavat ja sitoutuvat säilytetty mikrobien tuotteet (PAMPs, pathogen-associated molecular patterns), ja niillä on tärkeä rooli aktivointi synnynnäinen immuunivaste, on osoitettu olevan kriittinen isännän immuniteetin S. epidermidis sepsis. TLR2: n osoitettiin olevan kriittinen S. epidermidis-valmisteen puhdistuman kannalta hiiren sepsismimallissa (Strunk et al., 2010). Ihmisen vastasyntyneillä TLR2-ilmentymä lisääntyy S. epidermidis sepsiksen (Viemann et al.,, 2005), kuitenkin TLR-stimuloi immuunijärjestelmää raportoitiin olevan vähemmän taitavia aiheuttivat useita sytokiini vastauksia vastasyntyneillä kuin aikuisilla (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001) ja lipoteikhappo (LTA) (Xia et al., 2016) on väitetty olevan TLR2: n vaikuttajia. Kuitenkin tutkimuksissa PIA ja PSMs ei todennettujen kanssa isogenic mutantteja, ja mitä LTA, on ollut viime aikoina näyttöä siitä, että stafylokokki lipopeptides sijaan LTA ovat todellisia immuuni-stimuloivia aineita (Hashimoto et al., 2006)., Lisäksi S. aureus se oli osoittanut, että PSMs eivät ole suoraan agonistit TLR2, mutta johtaa vapauttaa lipopeptides solun pinnalta ja näin on toissijainen, TLR2-stimuloiva vaikutus (Hanzelmann et al., 2016), vaikutus todennäköisesti esiintyy myös S. epidermidiksessä.
perustuu siihen, että formyylipeptidireseptori 2 (FPR2) tunnistaa PSMs: n (Kretschmer et al., 2010), tämä G protein-coupled chemoattractant reseptori on toinen mahdollisesti tärkeä host-reseptorin vaste vastaan S. epidermidis. Kuten S., aureus, PSM-FPR2 aktivointi saa aikaan kemotaksista, rae exocytosis, ja interleukiini-8 (IL-8) vapauttaa PMNs (Wang et al., 2007; Kretschmer ym., 2010). Tutkimukset vaikutuksista PSMs ja Haittoja immuunivastetta on tutkittu vain puhdasta PSMs S. epidermidis (Cheung et al., 2010), ja toistaiseksi ovat estäneet lukuisia geneettisiä psm loci S. epidermidis ja yleinen vaikeus tuottaa isogenic poistetaan mutantteja Huonoja puolia. Kuitenkin tuoreessa tutkimuksessa johtuvan keskeinen rooli mobiili geneettinen elementti-koodattu, hyvin tuotettu PSM-mec S., epidermidis tulehduksessa ja immuunikierrossa käyttäen isogeenisiä psm-mec-mutantteja (Qin et al., 2017).
Täydentää myös tärkeä rooli immuniteetin S. epidermidis sepsis. Komplementtitekijän C3 ja IgG puutteisiin liittyy suurempi vastasyntyneen sepsiksen riski (Lassiter ym., 1991). Lisäksi tutkimuksen avulla ex-vivo-koko-verta sepsis malli, S. epidermidis aiheuttama merkittävästi pienempi täydentää aktivointi vastasyntyneillä kuin aikuisilla verta (Granslo et al., 2013)., Tämä havainto viittaa siihen, että on maturational puutos vastasyntyneiden täydentää järjestelmä, joka osittain saattaa selittää, miksi vastasyntyneet ovat alttiimpia S. epidermidis septinen infektiot kuin aikuiset. Lisäksi tässä tutkimuksessa korostetaan komplementtijärjestelmän merkitystä isäntäpuolustuksessa S. epidermidis sepsistä vastaan.
kuten komplementti, keskosten neutrofiileissa ilmenee maturaatiopuutosta. Ne osoittavat heikentynyttä oksidatiivista puhkeamista verrattuna niihin, jotka on eristetty termeistä vastasyntyneet S. epidermidis (Björkqvist et al., 2004)., Tämä saattaa osittain selittää myös keskosten lisääntyneen herkkyyden S. epidermidis sepsikselle. Mielenkiintoista kyllä, monosyytit, toinen solu-komponentti synnynnäinen immuunivaste, eivät ole välttämättömiä isäntä puolustus vastaan vastasyntyneiden S. epidermidis sepsis sekä ihmisen vastasyntyneiden ja aikuisten monosyyttien näytetään vastaavia phagocytic ja solunsisäisiä kapasiteetti (Strunk et al., 2007). Yhdessä, tämä osoittaa, että neutrofiilien on erityisen tärkeä rooli immuunijärjestelmän vasteen aikana S. epidermidis sepsis.,
Vaikka on olemassa lukuisia tutkimuksia omistettu ymmärrystä rooli synnynnäinen immuunivaste aikana S. epidermidis sepsis, tutkimus rooli adaptiivisen immuunivasteen S. epidermidis septinen infektiot on edelleen vähäistä. Koska nämä infektiot ovat luonteeltaan akuutteja, on epätodennäköistä, että adaptiivisella immuunivasteella on merkittävä rooli. Vastaavasti, laskimoon siirtää immunoglobuliini rahoittajien kanssa korkeat titterit vasta-aineita S. epidermidis ja S. aureus ei suojaa sepsis ennenaikaisilla vastasyntyneillä (Bloom et al., 2005; DeJonge et al., 2007).,
päätelmät
CoNS-infektiot ja erityisesti S. epidermidis aiheuttavat merkittävää lääketieteellistä ja taloudellista taakkaa julkiselle terveydenhuollolle. Lisäksi antibioottiresistenssin, hoitovaihtoehtoja ovat yhä rajalliset. Kuitenkin, poistaminen S. epidermidis-bakteereja näyttää sopimatonta, koska ne ovat olennainen osa hyödyllisiä mikrobisto on ihon ja limakalvojen.
S: N hyödyllinen rooli., epidermidis kolonisaatio ehkäisyssä taudinaiheuttaja liikakasvua iholla, tulosten perusteella hiirillä on annettu stimulaatio immuunijärjestelmän vasteen. Kun hiiren ihomalli tuskin heijastaa ihmisen ihon tilannetta, jää kuitenkin huonosti ymmärretyksi, ovatko löydökset siirrettävissä ihmisiin. Lisäksi, onko tehtävä mahdollinen suora bakteeri vuorovaikutusta S. epidermidis ja taudinaiheuttajia iholla vielä tutkittava.
S. epidermidiksen immuunivaste infektion aikana on mahdollisesti vielä heikompi., Vuonna krooninen, biofilm-liittyvän infektion on vaikea erottaa vaikutuksia leikkaus taajamassa ja ne välittyvät spesifisten solun pintaproteiinien osia. Aikana sepsis, luonne ja rooli pro-inflammatorisia sytokiineja sekä tulehdusta polkuja vastauksena S. epidermidis on edelleen yhtä huonosti määritelty. Selvittäminen näitä mekanismeja antaa myös enemmän tietoa siitä, miksi vastasyntyneet ovat erityisen alttiita S. epidermidis-infektio. S: n molekyylibiologian työkaluissa on edistytty., epidermidis ja miinukset yleensä ovat suureksi avuksi näissä pyrkimyksissä ja auttavat erityisesti erottamaan suorat ja toissijaiset vaikutukset toisistaan. Selvästi, syvempää ymmärrystä isännän immuunivastetta nämä infektiot on kriittinen kehittämiseen S. epidermidis rokotteiden ja hoitomuotojen.
Kirjailijapanokset
TN ja MO kirjoittivat käsikirjoituksen. MP ja TN laativat luvut.,
eturistiriita Lausunto
kirjoittajat ilmoittavat, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.
Kiitokset
Tämä tutkimus tukivat Sisäiset Tutkimus-Ohjelma National Institute of Allergy ja Tartuntatautien (NIAID), US National Institutes of Health (NIH), hankkeen numero ZIA AI001080.
Kloos, W. E., and Simpelwhite, M. S. (1975)., Staphylococcus-ja Micrococcus-lajien ja muiden aerobisten bakteerien jakautuminen ja pysyvyys ihmisen iholla. Appl. Mikrobioli. 30, 381–385.
PubMed Abstract / Google Scholar















