Bevezetés
koaguláz-negatív staphylococcusok (hátrányok) a véralvadási enzim koaguláz hiánya által klinikailag besorolt staphylococcus Fajok heterogén csoportja. Ez megkülönbözteti őket a Staphylococcus aureustól és néhány klinikailag kevésbé fontos koaguláz-pozitív fajtól., Napjainkban a CoNS a klinikai kultúrákban a leggyakrabban izolált baktériumok, amelyek jelentős nozokomiális kórokozókként jelentek meg. A CoNS fertőzés kockázati tényezői közé tartozik a bentlakásos orvosi implantátumok, például intravaszkuláris katéterek vagy a rákkezelés vagy a HIV/AIDS okozta immunszuppresszió jelenléte. CoNS fertőzések kezelése bonyolítja a megjelenése antibiotikum-rezisztens törzsek (mint például a különösen MRSE, meticillin-rezisztens S. epidermidis) (Rogers et al., 2009).,
A hátrányok az emberi bőr és a nyálkahártyák normál flórájának szerves részét képezik, és előnyben részesítik a nedves területeket (Grice et al., 2009). S. epidermidis, a klinikai tenyészetekből kinyert Leggyakoribb ellenszenv, a hónalj, az ágyék, az elülső nares, a kötőhártya, a lábujjak és a perineális terület (Kloos and Musselwhite, 1975) kolonizálódik. Míg általában ártalmatlan vagy akár hasznos gyarmatosítók, ha a gazdaszervezet epiteliális gátja veszélybe kerül, az olyan hátrányok, mint az S. epidermidis, súlyos fertőzéseket okozhatnak., Valójában CoNS fertőzések teszik ki a legtöbb bakteriális szepszis és idegen testtel kapcsolatos fertőzések, S. epidermidis, hogy a legjelentősebb faj ebben a tekintetben (Rogers et al., 2009).
az S. epidermidisre adott gazdaszervezet immunválasza, az immuntolerancia mechanizmusa és az S. epidermidis commensals által nyújtott immunjellemzők csak most kezdenek kibontakozni. Ez a felülvizsgálat az S. epidermidisre mint commensals-ra adott gazdaszervezeti válaszról, valamint a biofilm és szeptikus fertőzések összefüggésében opportunista baktériumokról szóló legújabb kutatásokat tartalmazza.,
a gazdaszervezet immunválasza az S. epidermidisre, mint Commensal
egyre több bizonyíték van arra, hogy a bőr mikrobiotája általában fontos hatással van az immunrendszerre (Belkaid and Tamoutounour, 2016). Annak ellenére, hogy CoNS, hogy az egyik legfontosabb bőr gyarmatosítók, specifikus vizsgálatok a gazdaszervezet immunválasz CoNS kolonizáció és létesítmény korlátozott. Azok, amelyek rendelkezésre állnak, az S. epidermidis prototípusos CoNS fajok által a bőr kolonizációjára adott immunválaszra összpontosítottak,valamint az ilyen kolonizáció előnyei a gazdaszervezet számára.,
például a Gallo csoport az S. epidermidis potenciálisan előnyös funkcióit bőrkommensként írta le. Nevezetesen, Lai et al. arról számoltak be, hogy az S. epidermidis lipoteichoic acid (LTA) a TLR (toll-szerű receptor) 2-t érintő mechanizmuson keresztül csökkenti a bőr gyulladását (Lai et al., 2009). Ugyanezek a szerzők később arról is beszámoltak, hogy S., epidermidis (de nem más baktériumok) termel egy további jellemző anyag kevesebb, mint 10 kD, amely aktiválja TLR2, és ezáltal indukálja antimikrobiális peptid termelés, amely növelte a kapacitást a sejt lizátumok, hogy gátolja a növekedést a csoport Streptococcus és S. aureus (Lai et al., 2010) (1a. Míg ezek az eredmények hangsúlyozzák az S előnyös funkcióját., epidermidis a bőrön, ami a stimuláló tényező, meg kell látni annak fényében, hogy a gyakran jelentett aktiválása TLR2 által LTA vitatták: lta Tisztítás rendkívül nehéz, és gyakran tartalmaz TLR2-stimuláló lipopeptid szennyező anyagok, beleértve a kereskedelmi készítmények (Hashimoto et al., 2006). Ezek az eredmények tehát minden bizonnyal további értékelést igényelnek az S. epidermidis izogén mutánsainak felhasználásával a stimuláló tényező jellegének ellenőrzése érdekében.
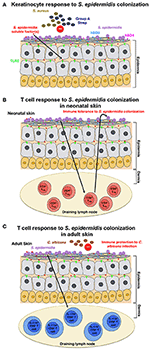
1.ábra., Az S. epidermidis kolonizációra adott gazdaszervezeti válasz modellje (a) S. epidermidis gyarmatosítja a bőr epidermiszét, egy erősen szervezett szerkezetet, amely főként keratinocitákból áll. Az S. epidermidis kolonizációra adott válaszként a mintafelismerő receptorok (PRRS), mint például a KERATINOCITÁKON lévő tlr2, kötődnek az S. epidermidis által szekretált rosszul jellemzett faktorokhoz, hogy stimulálják a jelátviteli kaszkádot, amely például a β-defenzin 2(hBD2) és a hBD3 antimikrobiális peptidek előállítását eredményezi. Ezek az antimikrobiális peptidek védelmet nyújtanak a bőr S. aureus és az A csoportba tartozó Streptococcus fertőzések ellen., B) az S. epidermidis kolonizáció specifikus CD4 + FOXP3 + Treg választ idéz elő,amely elengedhetetlen az S. epidermidis elleni immuntoleranciához. Úgy gondolják, hogy az immuntoleranciát csak az újszülött időszakban állapítják meg, mivel a felnőtt egerekben a kolonizáció nem mutatott toleranciát. C) egy másik modellben, a felnőtt egerekben kapott eredmények alapján, az S. epidermidis bőr kolonizációja specifikus IL-17A+ CD8 + T-sejt választ vált ki., Ezek a T-sejtek a CD103+ dendritikus sejtek által a nyirokcsomót ürítő bőrben fokozzák a veleszületett antimikrobiális védelmet, és megakadályozzák a gomba, a C. albicans invázióját.
Scharschmidt et al. azt mutatta, hogy az S. epidermidis kolonizációja helyi, valamint szisztémás, specifikus CD4 + T sejtválaszt váltott ki, amint azt a specifikus CD4+ T sejtek dúsítása bizonyítja mind a bőrleeresztő nyirokcsomókban, mind a lépben (Scharschmidt et al., 2015). Ez a csoport tervezte az S., epidermidis bőr izolátum, Tü3298 törzs, a fluoreszkáló fehérjéhez kapcsolódó 2W (Epi-2W) peptid antigén kifejezésére. A kolonizáció elérése érdekében a tervezett Epi-2W törzs 108-109 CFU-ját 3 naponta alkalmazták a c57bl/6 egerek hátsó bőrére, összesen három alkalmazásra. Ezzel a modellel a szerzők azt illusztrálták, hogy a kifejezetten CD4+ szabályozó T (Treg) sejtek terjeszkedése kritikus szerepet játszik az S. epidermidis immuntoleranciájában., Az ilyen tolerancia azonban korai bakteriális kolonizációt igényelt az újszülött szakaszban, mivel a felnőtt egerekben a kolonizáció nem állapított meg toleranciát (1b ábra). A munka Scharschmidt et al. különösen érdekes, mivel tudományos indokot ad a bőr mikrobiotájának újszülöttkori modulációjára, mint a gyulladásos bőrbetegségek, különösen az atópiás dermatitisz (AD) kezelésére szolgáló terápiás lehetőségre.
Az AD-betegek bőrét gyakran S. aureus (Higaki et al., 1999). Számos tanulmány azt mutatja, hogy S., az epidermidis a második leggyakoribb mikroba, amelyet az AD által érintett bőrelváltozásokból izolálnak (Hon et al., 2005, 2012, 2016). Bár ez nem közvetlenül S. epidermidis patogenezisében AD, mivel a normális és gyakori bőség a bőrön, a legutóbbi vizsgálatok, Hon et al. 100 AD-s beteg bakteriális izolátumait vizsgálták, és megállapították, hogy az S. epidermidis jelen van a legsúlyosabban AD-érintett bőrelváltozásokban (Hon et al., 2016). Így a korábban javasolt antagonista kapcsolat S. epidermidis és S. aureus között (Cogen et al., 2010; Iwase et al.,, 2010), tanulmányukban nem fordítottak kevesebb betegségre. Inkább az eredmények azt sugallták,hogy az S. epidermidis kolonizáció súlyosabb AD-betegséggel jár. Természetesen további vizsgálatokra van szükség az S. epidermidis AD patogenezisben betöltött szerepének, valamint az S. aureus és az S. epidermidis közötti kapcsolat jellegének értékeléséhez AD léziókban.
Naik et al. bizonyított, hogy az S. epidermidis kolonizációja felnőtt egerekben bőrspecifikus T-sejt választ vált ki (Naik et al., 2015). Ebben a vizsgálatban a csoport ~5 ml 107-109 CFU / ml S-t alkalmazott., epidermidis az egész egér bőrfelületén minden második napon összesen négy alkalmazáshoz, egy olyan eljáráshoz, amellyel beszámoltak arról, hogy stabil kolonizációt kapnak. A vizsgálatban indukált T-sejtek azonban a CD4+ T sejtek helyett IL-17A+ CD8+ T sejtek voltak, mint a Scharschmidt et al. tanulmány (Scharschmidt et al., 2015). A szerzők kimutatták, hogy ezek az IL-17A+ CD8+ T sejtek immunitást biztosítanak a bőr C. albicans fertőzésére (1C ábra); azonban nem vizsgálták, hogy ez más kórokozókkal, nevezetesen S. aureus (Naik et al., 2015).,
mind a Scharschmidt et al. és Naik et al. a vizsgálatok az S. epidermidis kolonizációra adott gazdaszervezet immunválaszát vizsgálták, ám megállapításaik meglehetősen eltérőek. Ezek a különbségek az egérmodellek beállításának árnyalatainak, vagy esetleg az alkalmazott specifikus S. epidermidis törzseknek is tulajdoníthatók. Az eredmények közötti különbségek ellenére a két vizsgálat együttesen azt mutatta, hogy az S. epidermidissel történő kolonizáció adaptív T-sejt választ vált ki egerekben. Nem világos azonban, hogy az S. epidermidis kolonizációjának ilyen immunjellemzője az emberekben is megfigyelhető-e.,
Szembeni Immunitás S. epidermidis a Biofilm-Összefüggő Fertőzések
Nagyon kevés vizsgálatot végeztek, hogy értékelje a immunválasz CoNS biofilm-összefüggő fertőzések, különösen, mint a S. aureus. A legtöbb ilyen tanulmány az S. epidermidisre összpontosított. CoNS biofilm-hez társuló fertőzések gyakran fordulnak elő orvosi implantátumokban szenvedő betegeknél, az S. epidermidis a legvalószínűbb visszanyerendő faj (Rogers et al., 2009)., A biofilmek az extracelluláris DNS-ből, fehérjékből és poliszacharidokból álló amorf, saját termelésű extracelluláris mátrixba zárt baktériumsejtek összetett, térben változatos agglomerációi (Otto, 2008). A biofilmhez társuló fertőzések több okból is rendkívül rezisztensek az antibiotikum-kezeléssel szemben, beleértve a csökkent metabolizmust és az extracelluláris mátrixon keresztüli behatolást (Mah and O ‘ Toole, 2001). Következésképpen a kezelés gyakran megköveteli a fertőzött eszköz vagy szövet sebészeti eltávolítását., Csak az Egyesült Államokban évente mintegy 2 milliárd dollárt költenek ortopédiai implantátumokkal kapcsolatos fertőzések kezelésére és kezelésére (Darouiche, 2004; Parvizi et al., 2010).
általánosságban elmondható, hogy az S. epidermidis biofilmhez társuló fertőzésre adott gazdaszervezet immunválasz nem védő vagy elegendő a fertőzés törléséhez. Ezért a legtöbb S. epidermidis biofilmhez kapcsolódó fertőzés krónikus. A témában eddig végzett legtöbb tanulmány olyan In vitro vizsgálatok, amelyek összehasonlították a biofilmmel termesztett planktonikus baktériumokat. Számos tanulmány eredményei arra utalnak, hogy S., az epidermidis biofilmek a fagocitikus funkciókban csillapítást és gyulladáscsökkentő citokinek termelődését indukálják planktonikus társaikhoz képest (2.ábra). Ellentmondásos eredményekről számoltak be az S. epidermidis biofilmeknek a fagocitikus aktivitásra gyakorolt hatásáról. Két vizsgálat arról számolt be, hogy a humán neutrofilek és az elsődleges humán monocita eredetű makrofágok tapadása és fagocitózisa szignifikánsan fokozódott biofilmben termesztett baktériumokkal (Heinzelmann et al., 1997; Spiliopoulou et al.,, 2012), míg mások arról számoltak be, hogy a biofilm exopoliszacharid, poliszacharid intercelluláris adhézin (PIA) (Mack et al., 1996) alapvető szerepet játszik a Murin peritoneális makrofágok fagocitikus kapacitásának csillapításában (Shiau and Wu, 1998), J774A.1 murine makrofágok (Schommer et al., 2011) és az emberi PMNs. A szakirodalomban azonban konszenzus van az S. epidermidis biofilm fagocitikus megölésre gyakorolt hatásával kapcsolatban. Emberi makrofágok általi gyilkolás (Spiliopoulou et al., 2012) és a PMNs (Vuong et al., 2004; Kristian et al.,, 2008), valamint a leukociták által közvetített antitest-mediált leölés (Cerca et al., 2006) erősen gyengülnek biofilmben termesztett baktériumok jelenlétében.
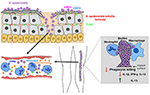
2.ábra. Az S. epidermidis fertőzésekre adott gazdaszervezeti válasz modellje. A bőrön keresztül történő áttörés S. epidermidis véráramba jutását eredményezheti, ami bakterémiát és akut szepszises eseteket okozhat., Fogadó szembeni immunitás szeptikus fertőzések erősen függ a neutrofil granulociták, kiegészítik, valamint az aktiválás PRRs beleértve a G-fehérje-kapcsolt receptorok (határok között mozog), mint a TLR2 (zöld), valamint FPR2 (kék). Az orvosi implantátumok biofilmhez kapcsolódó fertőzései a készülék behelyezése során fellépő szennyeződésekből vagy ritka esetekben a véráramból származnak. Az orvosi implantátumokkal rendelkező betegek érzékenyek az S. epidermidis szepszisre, mivel a biofilm baktériumok gyakran elterjedhetnek a véráramba., A biofilmhez társuló fertőzésekre adott immunválasz általában nem hatékony, mivel a biofilmek gátolják a pmns-ek és a makrofágok fagocitikus leölését. Ezenkívül az immunrendszert a gyulladáscsökkentő citokinek, például az IL-13 fokozott termelése felé fordítják, miközben korlátozzák a pro-gyulladásos citokinek, köztük az IL1-béta, az IL-12 és az IFN-gamma szekrécióját.
a komplement szerepe a CoNS biofilm-hez társuló fertőzésekben meglehetősen tisztázatlan. Míg S., az epidermidis biofilm-termelő törzsek erősebb választ váltanak ki a komplementkomponensek aktiválásában és felszabadulásában, mint az izogén PIA-negatív, így biofilm-negatív társaik (Kristian et al., 2008; Fredheim et al., 2011), az ilyen KOMPLEMENT kiadás nem lefordítani fokozott fagocitikus gyilkos. S. epidermidis pia-pozitív biofilmek kiváltotta C3A kiadás, de védett S. epidermidis C3b és IgG opsonization és PMN-mediált gyilkos (Kristian et al., 2008)., Nevezetesen-míg egyes szerzők megpróbálták a specifikus hatásokat a pia-nak tulajdonítani, nem pedig a biofilmképződésnek, az aggregátumok mechanikusan megsemmisítésével (Vuong et al., 2004), egyik vizsgálatban sem lehet egyértelműen különbséget tenni a biofilm agglomerációk hatásai és az exopoliszacharid PIA közvetlen hatása között. Ami a pia állítólagos pro-gyulladásos tulajdonságait illeti (Kristian et al., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), az a tény, hogy a PIA egy nehezen tisztítható anyag, az izogén pia-negatív mutánsok határozottan eltérő sejtfelszín-tulajdonságokkal rendelkeznek, megnehezíti a megfigyelt hatások közvetlen hozzárendelését a PIA molekulához.
arról számoltak be, hogy az S. epidermidis biofilm által termesztett törzsek gyulladásgátló, nem pedig gyulladásgátló citokinek (Spiliopoulou et al., 2012). Az adott vizsgálatban az élő S-vel stimulált primer humán monocita eredetű makrofágok., epidermidis 24-h bacter előállított alacsonyabb szintű pro-inflammatorikus citokinek (IL-1beta, IFN-gamma, IL-12), emelt szint, az anti-gyulladásos citokin IL-13, mint planktonic sejtek felnőtt 2 h. Nyilvánvaló, hogy ebben az összehasonlítás más tényezők, mint például a leginkább határozatképesség-érzékelő-szabályozott pro-gyulladásos tényezők, mint például a fenol-oldható modulins (PSMs) (Cheung et al., 2014) az alábbiakban tárgyalt, tehető felelőssé a megfigyelt különbségek helyett biofilm kialakulását magát., Azonban összehasonlítva biofilm-pozitív izogén biofilm-negatív (PIA-negatív, Embp, vagy aap-negatív) törzsek, Schommer et al. a 774a.1 makrofágokban csökkent gyulladásos választ figyeltek meg, csökkent NF-kappaB aktivációval és csökkent IL-1BETA termeléssel (Schommer et al., 2011).
keveset tudunk arról, hogy az adaptív immunrendszer hogyan reagál a biofilm okozta fertőzésekre, részben azért, mert nehéz hosszú távú S. epidermidis biofilm fertőzési modelleket létrehozni. Vuong et al. kifejlesztettek egy katéterrel kapcsolatos Murin fertőzés modell egy S., epidermidis biolumineszcens törzs, az úgynevezett SE Xen43, amellyel képesek voltak valós időben figyelemmel kísérni az S. epidermidis biofilm okozta fertőzés progresszióját (Vuong et al., 2008). Összehasonlítva a Nu/Nu (T-sejt-hiányos) és a CBSCBG-MM (t/B sejt-hiányos) érzékenységét az S. epidermidis biofilmhez társuló fertőzéssel, immuno-Kompetens vad típusú Balb/C egerekkel, a szerzők megállapították, hogy különösen a Nu/Nu egerek érzékenyebbek voltak a fertőzésre, jelezve a T-sejt által közvetített immunitás fontos szerepét az S. epidermidis biofilm-hez társuló fertőzéssel szemben.
védettség az S-vel szemben., epidermidis a szepszis során
a vérben lévő hátrányok (bakterémia) jelenléte, amelyek gyakran a biofilmekből származó baktériumok szétszóródásából származnak, akut szepszist okozhatnak (2.ábra). CoNS a bacteremia jelentős egészségügyi költségekkel, morbiditással és mortalitással jár (Bearman and Wenzel, 2005). Az immunhiányos és koraszülött újszülöttek a legsebezhetőbbek a CoNS sepsis ellen, mivel az S. epidermidis a legelterjedtebb CoNS faj (Cheung and Otto, 2010).
ellentétben az S. epidermidis biofilmhez társuló, krónikus fertőzésekkel, S., az epidermidis szepszis természeténél fogva akut. Ezért a gazdaszervezet immunválasza az S. epidermidis szepszisre, amely nagyrészt a véráramban zajlik, meglehetősen különbözik a szövetben élő S. epidermidis biofilm okozta fertőzésektől. Mivel az újszülöttek fokozott érzékenységet mutatnak az S. epidermidis szepszisre, az ezzel kapcsolatos vizsgálatok többsége az S. epidermidis újszülött szepszisével foglalkozott. Ezért a következő vita az S. epidermidis szepszisre adott válaszként az újszülött immunitásra összpontosít.,
a veleszületett immunválasz fontos eleme a veleszületett immunsejtek, amelyek közül a neutrofilek dominálnak a számban. A neutrofilek a gazdaszervezeti receptorok repertoárján keresztül felismerik a mikrobákat (lásd alább), lenyelik őket, és a fagoszómán belül reaktív oxigénfajok és a degranulációnak nevezett folyamat során felszabaduló antimikrobiális fehérjék (Malech et al., 2014). Ezenkívül a lizált neutrofilek neutrofil extracelluláris csapdákat (hálókat) képezhetnek a behatoló mikrobák megkötésére és megölésére (Brinkmann et al., 2004).,
Több mintafelismerő receptor (PRRS), amelyek felismerik és megkötik a konzervált mikrobiális termékeket (PAMPs, kórokozóval összefüggő molekuláris minták), és alapvető szerepet játszanak a veleszületett immunválasz aktiválásában, kritikusnak bizonyultak az S. epidermidis szepszis elleni gazdaállamban. A tlr2-ről kimutatták, hogy kritikus az S. epidermidis clearance-e szempontjából egy egér sepsis modellben (Strunk et al., 2010). Az emberi újszülötteknél a TLR2 expresszió növekedése az S. epidermidis sepsis (Viemann et al.,, 2005) azonban a TLR-stimulált immunrendszerről számoltak be, hogy kevésbé jártas az újszülötteknél több citokin válasz kiváltásában, mint a felnőtteknél (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001) és lipoteichoic acid (LTA) (Xia et al., 2016)azt állították, hogy a tlr2 effektorai. A vizsgálatok azonban a PIA PSMs nem ellenőrizte isogenic mutánsok; pedig LTA, hogy már elmúlt bizonyíték arra, hogy staphylococcus lipopeptides inkább, mint LTA az igazi immunrendszer-stimuláló szerek (Hashimoto et al., 2006)., Ezenkívül S. aureus-ban kimutatták, hogy a PSM-ek nem a TLR2 közvetlen agonistái, hanem lipopeptidek felszabadulásához vezetnek a sejtfelszínről, így másodlagos, TLR2-stimuláló hatásuk van (Hanzelmann et al., 2016), valószínűleg az S. epidermidisben is jelen van.
azon a tényen alapul, hogy a formil-peptid receptor 2 (FPR2) felismeri a PSMs-t (Kretschmer et al., 2010), ez a G fehérjéhez kapcsolt kemoatraktáns receptor egy másik potenciálisan fontos gazdaszervezet-receptor az S. epidermidis elleni válaszban. Amint az az S., az aureus, a PSM-FPR2 aktiváció kemotaxist, granulátum exocitózist és interleukin-8 (IL-8) felszabadulást idéz elő a PMNs-ből (Wang et al., 2007; Kretschmer et al., 2010). A CoNS PSMs immunválaszra gyakorolt hatásáról csak S. epidermidis (Cheung et al., 2010), és eddig akadályozta a sok genetikai psm loci S. epidermidis és az Általános nehézséget, hogy készítsen izogén deléciós mutánsok CoNS. Egy nemrégiben készült tanulmány azonban döntő szerepet tulajdonított az S Mobil genetikai elem kódolt, magasan előállított PSM-mec-nek., epidermidis gyulladás és immunválasz, izogén psm-mec mutánsok (Qin et al., 2017).
a komplement fontos szerepet játszik az S. epidermidis szepszis elleni immunitásban is. A C3 KOMPLEMENT faktor és az IgG hiányosságai az újszülöttkori CoNS-szal összefüggő szepszis (Lassiter et al., 1991). Továbbá egy ex vivo teljes vérmérgezés modelljét alkalmazó vizsgálatban az S. epidermidis szignifikánsan alacsonyabb komplementaktivációt váltott ki újszülöttkorban, mint a felnőtt vér (Granslo et al., 2013)., Ez a megállapítás arra utal, hogy az újszülött KOMPLEMENT rendszerében maturációs hiány van, ami részben megmagyarázhatja, hogy az újszülöttek miért érzékenyebbek az S. epidermidis szeptikus fertőzésekre, mint a felnőttek. Ezenkívül ez a tanulmány kiemeli a komplementrendszer fontosságát az S. epidermidis szepszis elleni gazdavédelemben.
a komplementhez hasonlóan a koraszülöttek neutrofiljei is maturációs hiányt mutatnak. Károsodott oxidatív burst-et mutatnak, mint az S. epidermidis stimulálásával izolált újszülöttek (Björkqvist et al., 2004)., Ez részben megmagyarázhatja a koraszülöttek fokozott érzékenységét az S. epidermidis szepszisre. Érdekes módon a monociták, a veleszületett immunválasz másik celluláris összetevője, nem nélkülözhetetlenek az újszülöttkori S. epidermidis szepszis elleni gazdaszervezeti védekezéshez, mivel mind az emberi újszülött, mind a felnőtt monociták hasonló fagocitikus és intracelluláris gyilkos képességet mutattak (Strunk et al., 2007). Ez együttesen azt jelzi, hogy a neutrofilek különösen fontos szerepet játszanak az immunválaszban az S. epidermidis szepszis során.,
bár számos tanulmány foglalkozik a veleszületett immunválasz szerepének megértésével az S. epidermidis szepszis során, az adaptív immunválasz S. epidermidis szeptikus fertőzésekben betöltött szerepének kutatása továbbra is korlátozott. Mivel ezek a fertőzések akut jellegűek, nem valószínű, hogy az adaptív immunválasz jelentős szerepet játszik. Ennek megfelelően az immunglobulin intravénás transzferje az S. epidermidis vagy S. aureus elleni antitestek nagy titerű donoroktól nem sikerült megvédeni a szepszist a koraszülött újszülötteknél (Bloom et al., 2005; DeJonge et al., 2007).,
következtetések
hátrányok a fertőzések és különösen az S. epidermidis jelentős egészségügyi és gazdasági terhet jelentenek a közegészségügy számára. Ezenkívül az antibiotikum-rezisztencia kialakulásával a kezelési lehetőségek korlátozottak. Az S. epidermidis baktériumok eltávolítása azonban nem megfelelőnek tűnik, mivel ezek szerves részét képezik a bőrön és a nyálkahártyákon található jótékony mikrobiotának.
az S jótékony szerepe., epidermidis kolonizáció a megelőzés a kórokozó elszaporodását a bőrön alapuló eredmények egerekben, tulajdonították stimulálása az immunválasz. Azonban az egérbőr modell alig tükrözi az emberi bőr helyzetét, továbbra is rosszul érthető, hogy az eredmények átadhatók-e az embereknek. Továbbá meg kell vizsgálni, hogy van-e szerepe az S. epidermidis és a kórokozók közötti lehetséges közvetlen bakteriális kölcsönhatásnak a bőrön.
a fertőzés során az S. epidermidisre adott immunválasz valószínűleg még kevésbé ismert., Krónikus, biofilmhez társuló fertőzésben nehéz különbséget tenni a nyíró agglomeráció és a specifikus sejtfelszíni komponensek által közvetített hatások között. A szepszis során a pro-gyulladásos citokinek és a gyulladásos útvonalak jellege és szerepe az S. epidermidisre adott válaszként továbbra is ugyanolyan rosszul definiált. E mechanizmusok tisztázása további információt nyújt arról a kérdésről is, hogy az újszülöttek miért különösen érzékenyek az S. epidermidis fertőzésre. Előrelépés történt az S molekuláris biológiai eszközeivel kapcsolatban., az epidermidis és a hátrányok általában nagy segítséget jelentenek ezekben a törekvésekben, és különösen segítik a közvetlen és másodlagos hatások megkülönböztetését. Nyilvánvaló, hogy az ezekre a fertőzésekre adott gazdaszervezet immunválaszának mélyebb megértése kritikus lesz az S. epidermidis vakcinák és új terápiák kifejlesztése szempontjából.
szerző
TN és MO írta a kéziratot. Az MP és a TN készített számokat.,
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
ezt a tanulmányt a National Institute of Allergy and Infectious Diseases (NIAID), az amerikai National Institutes of Health (NIH) Intramural Research programja, a Zia AI001080 projektszáma támogatta.
Kloos, W. E., and Musselwhite, M. S. (1975)., A Staphylococcus és Micrococcus fajok és más aerob baktériumok emberi bőrön való eloszlása és perzisztenciája. Appl. Mikrobiol. 30, 381–385.
PubMed Abstract / Google Scholar















