a fehérjék építőkövei aminosavak, amelyek kis szerves molekulák, amelyek egy aminosavcsoporthoz, egy karboxilcsoporthoz, egy hidrogénatomhoz és egy oldalláncnak nevezett változó komponensből állnak (lásd alább). Egy fehérjén belül több aminosavat összekapcsolnak peptidkötésekkel, ezáltal hosszú láncot képeznek., A peptidkötéseket egy biokémiai reakció képezi, amely kivonja a vízmolekulát, mivel egy aminosav aminosavcsoportjához csatlakozik a szomszédos aminosav karboxilcsoportjához. A fehérje elsődleges szerkezetének az aminosavak lineáris szekvenciáját tekintik.
a fehérjék csak húsz aminosavból állnak, amelyek mindegyikének egyedi oldallánca van. Az aminosavak oldalláncai különböző kémiákkal rendelkeznek. Az aminosavak legnagyobb csoportja nempoláris oldalláncokkal rendelkezik., Számos más aminosavnak van pozitív vagy negatív töltésű oldallánca, míg másoknak poláris, de nem töltött oldalláncai vannak. Az aminosav oldalláncok kémiája kritikus fontosságú a fehérjeszerkezet szempontjából, mivel ezek az oldalláncok összekapcsolódhatnak egymással, hogy bizonyos formájú vagy konformációjú fehérjét tartsanak. A töltött aminosav oldalláncok ionos kötéseket képezhetnek, a poláris aminosavak pedig hidrogénkötéseket képezhetnek. Hidrofób oldalláncok kölcsönhatásba egymással keresztül gyenge van der Waals kölcsönhatások. Az ezen oldalláncok által alkotott kötések túlnyomó többsége nem szőtt., Valójában a cisztein az egyetlen aminosav, amely képes kovalens kötéseket kialakítani, amit az adott oldalláncokkal csinálnak. Az oldallánc-kölcsönhatások miatt az aminosavak szekvenciája és elhelyezkedése egy adott fehérjefelvezetőben, ahol a görbék és redők az adott proteinben fordulnak elő (1.ábra).,
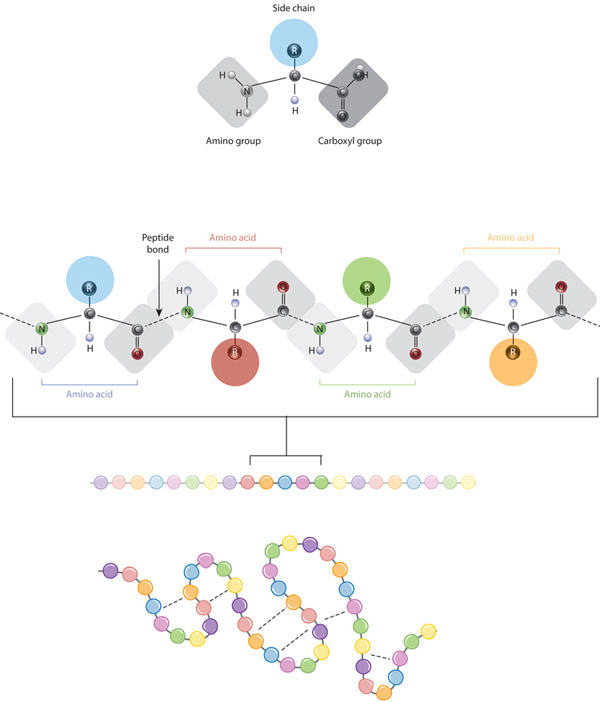
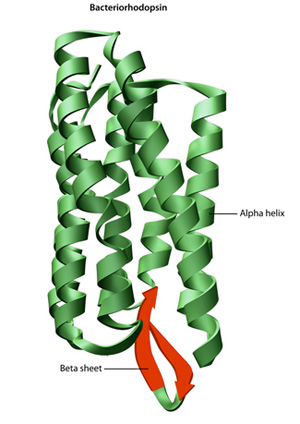
Az elsődleges szerkezet egy fehérje — az aminosav-szekvencia — meghajtók a hajtogató, így a kötés a lineáris aminosav-lánc, ami végső soron az határozza meg, hogy a fehérje egyedülálló három dimenziós forma. A proteinlánc szomszédos régióiban az aminocsoportok és a karboxilcsoportok közötti hidrogénkötés néha bizonyos hajtogatási mintákat okoz., Ezek a stabil hajtogatási minták alkotják a fehérje másodlagos szerkezetét. A legtöbb fehérje több hélixet és lapot tartalmaz, más kevésbé gyakori minták mellett (2.ábra). Az aminosavak egyetlen lineáris láncában — amelyet néha polipeptidnek is neveznek — kialakuló formációk és hajtások együttese alkotja a fehérje tercier szerkezetét. Végül a fehérje kvaterner szerkezete azokra a makromolekulákra utal, amelyek több polipeptidlánccal vagy alegységgel rendelkeznek.,
az újonnan szintetizált fehérje által elfogadott végső forma általában a leginkább energetikailag kedvező. Mivel a fehérjék összecsukódnak, különféle konformációkat tesztelnek, mielőtt elérnék végső formájukat, ami egyedülálló és kompakt. A hajtogatott fehérjéket az aminosavak között több ezer nem aktív kötéssel stabilizálják. Ezenkívül a fehérje és közvetlen környezete közötti kémiai erők hozzájárulnak a fehérje alakjához és stabilitásához., Például a sejt citoplazmában oldott fehérjék felületükön hidrofil (víz-szerető) kémiai csoportokkal rendelkeznek, míg hidrofób (víz-elhárító) elemeik általában be vannak dugva. Ezzel szemben a sejtmembránokba helyezett fehérjék valamilyen hidrofób kémiai csoportot mutatnak a felületükön, különösen azokban a régiókban, ahol a fehérje felülete membrán lipideknek van kitéve. Fontos azonban megjegyezni,hogy a teljesen hajtogatott fehérjék nem fagynak be. Inkább ezeknek a fehérjéknek az atomjai képesek kis mozgásokra.,
annak ellenére, hogy a fehérjéket makromolekuláknak tekintik, túl kicsik ahhoz, hogy mikroszkóppal is megjelenítsék őket. Tehát a tudósoknak közvetett módszereket kell alkalmazniuk arra, hogy kitalálják, hogyan néznek ki és hogyan hajtogatják őket. A fehérjeszerkezetek tanulmányozására alkalmazott leggyakoribb módszer a röntgen-kristályosodás. Ezzel a módszerrel a tisztított fehérje szilárd kristályait röntgensugárba helyezzük, az eltérített röntgensugarak mintázatát pedig arra használjuk, hogy megjósoljuk a több ezer Atom helyzetét a fehérje kristályban.















