Introduzione
Gli stafilococchi coagulasi-negativi (CoNS) sono un gruppo eterogeneo di specie stafilococciche classificate clinicamente dall’assenza dell’enzima coagulasi della coagulazione del sangue. Questo li distingue dallo Staphylococcus aureus e da alcune specie clinicamente meno importanti coagulasi-positive., Oggi, i CONTRO sono i batteri più comunemente isolati nelle colture cliniche e sono emersi come principali agenti patogeni nosocomiali. I fattori di rischio per l’infezione da CONS includono la presenza di impianti medici interni, come cateteri intravascolari o immunosoppressione dovuta al trattamento del cancro o all’HIV/AIDS. Il trattamento delle infezioni da CoNS è complicato dall’emergere di ceppi resistenti agli antibiotici (come in particolare MRSE, S. epidermidis resistente alla meticillina) (Rogers et al., 2009).,
I CONS sono parte integrante della normale flora sulla pelle umana e sulle mucose e colonizzano preferenzialmente le aree umide (Grice et al., 2009). S. epidermidis, la specie CONTRO più comune recuperata da colture cliniche, colonizza l’ascella, l’inguine, le narici anteriori, la congiuntiva, le ragnatele delle dita dei piedi e l’area perineale (Kloos e Musselwhite, 1975). Mentre i colonizzatori solitamente innocui o persino benefici, una volta che la barriera epiteliale ospite è compromessa, contro quale S. epidermidis possono causare le infezioni serie., In effetti, le infezioni da CoNS rappresentano la maggior parte della sepsi batterica e delle infezioni correlate a corpi estranei, con S. epidermidis che è la specie più significativa al riguardo (Rogers et al., 2009).
La risposta immunitaria dell’ospite a S. epidermidis, il meccanismo di tolleranza immunitaria e i benefici immunitari che S. epidermidis commensals può fornire, stanno appena iniziando a essere svelati. Questa recensione fornirà le ultime ricerche sulla risposta dell’ospite a S. epidermidis come commensali e come batteri opportunistici nel contesto del biofilm e delle infezioni settiche.,
La risposta immunitaria dell’ospite a S. epidermidis come commensale
Ci sono prove crescenti che il microbiota cutaneo in generale ha un impatto importante sul sistema immunitario (Belkaid e Tamoutounour, 2016). Nonostante i CONTRO siano tra i più importanti colonizzatori della pelle, sono stati limitati studi specifici sulla risposta immunitaria dell’ospite alla colonizzazione e alla creazione di CONS. Quelli che sono disponibili si sono concentrati sulla risposta immunitaria alla colonizzazione della pelle da parte della specie prototipica CoNS S. epidermidis e sui benefici che tale colonizzazione fornisce all’ospite.,
Ad esempio, il gruppo Gallo ha descritto le funzioni potenzialmente benefiche di S. epidermidis come un commensale cutaneo. Vale a dire, Lai et al. ha riferito che l’acido lipoteichoico di S. epidermidis (LTA) attraverso un meccanismo che coinvolge TLR (recettore toll-like) 2 riduce l’infiammazione cutanea (Lai et al., 2009). Gli stessi autori hanno anche riferito in seguito che S., epidermidis (ma non altri batteri) produce una sostanza non ulteriormente caratterizzata inferiore a 10 kD che attiva TLR2 e quindi induce la produzione di peptidi antimicrobici, che hanno aumentato la capacità dei lisati cellulari di inibire la crescita di streptococco di gruppo A e S. aureus (Lai et al., 2010) (Figura 1A). Mentre questi risultati sottolineano una funzione benefica di S., epidermidis sulla pelle, per quanto riguarda il fattore stimolante, devono essere visti alla luce del fatto che l’attivazione frequentemente riportata di TLR2 da parte di LTA è stata contestata: la purificazione di LTA è estremamente difficile e spesso contiene contaminanti lipopeptidici stimolanti TLR2, anche in preparazioni commerciali (Hashimoto et al., 2006). Questi risultati richiedono quindi certamente un’ulteriore valutazione utilizzando mutanti isogeni di S. epidermidis per verificare la natura del fattore stimolante.
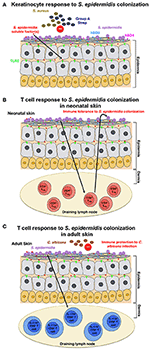
Figura 1., Modello della risposta dell’ospite alla colonizzazione di S. epidermidis (A) S. epidermidis colonizza l’epidermide della pelle, una struttura altamente organizzata composta principalmente da cheratinociti. In risposta alla colonizzazione di S. epidermidis, i recettori di riconoscimento del pattern (PRRs) come TLR2 sui cheratinociti si legano a fattori scarsamente caratterizzati secreti da S. epidermidis per stimolare una cascata di segnalazione che risulta, ad esempio, nella produzione dei peptidi antimicrobici β-defensin 2(hBD2) e hBD3. Questi peptidi antimicrobici forniscono protezione dalle infezioni cutanee da S. aureus e da streptococco di gruppo A., (B) La colonizzazione di S. epidermidis induce una risposta specifica di CD4+ FOXP3+ Treg, che è essenziale per tolleranza immune verso S. epidermidis come commensale. Si ritiene che la tolleranza immunitaria sia stabilita solo durante il periodo neonatale, poiché la colonizzazione nei topi adulti non è riuscita a stabilire la tolleranza. (C) In un modello diverso, basato sui risultati ottenuti in topi adulti, la colonizzazione della pelle da parte di S. epidermidis innesca una risposta specifica delle cellule T IL-17A+ CD8+., Innescato nella pelle drenante linfonodo da CD103 + cellule dendritiche, queste cellule T migliorare la innata difesa antimicrobica e prevenire l’invasione da parte del fungo, C. albicans.
Scharschmidt et al. ha dimostrato che la colonizzazione con S. epidermidis ha innescato una risposta locale, oltre che sistemica, specifica delle cellule T CD4 + come dimostrato dall’arricchimento di specifiche cellule T CD4 + sia nei linfonodi drenanti della pelle che nella milza (Scharschmidt et al., 2015). Questo gruppo ha progettato la S., epidermidis skin isolate, ceppo Tü3298, per esprimere l’antigene peptidico 2W (Epi-2W) legato a una proteina fluorescente. Per ottenere la colonizzazione, hanno applicato 108-109 CFU del ceppo Epi-2W ingegnerizzato sulla pelle dorsale dei topi C57BL/6 ogni 3 giorni per un totale di tre applicazioni. Utilizzando questo modello, gli autori hanno illustrato che l’espansione delle cellule T regolatorie CD4+ (Treg) svolge un ruolo critico nella tolleranza immunitaria a S. epidermidis., Tale tolleranza, tuttavia, ha richiesto una colonizzazione batterica precoce durante la fase neonatale, poiché la colonizzazione nei topi adulti non ha stabilito la tolleranza (Figura 1B). Il lavoro di Scharschmidt et al. è particolarmente intrigante in quanto fornisce la logica scientifica per la modulazione del microbiota cutaneo nel periodo neonatale come opzione terapeutica per il trattamento di malattie infiammatorie della pelle, e in particolare, per la dermatite atopica (AD).
La pelle dei pazienti con AD è spesso colonizzata da S. aureus (Higaki et al., 1999). Diversi studi dimostrano che S., epidermidis è il secondo microbo più comune isolato da lesioni cutanee affette da AD (Hon et al., 2005, 2012, 2016). Sebbene ciò non implichi direttamente S. epidermidis nella patogenesi dell’AD, a causa della sua normale e frequente abbondanza sulla pelle, nel più recente di questi studi, Hon et al. ha esaminato isolati batterici da 100 pazienti AD e ha scoperto che S. epidermidis è presente nelle lesioni cutanee più gravemente colpite da AD (Hon et al., 2016). Quindi, la relazione antagonistica precedentemente suggerita tra S. epidermidis e S. aureus (Cogen et al., 2010; Iwase et al.,, 2010), non si è tradotto in meno malattie nel loro studio. Piuttosto, i risultati hanno suggerito che la colonizzazione di S. epidermidis è associata a una malattia AD più grave. Certamente, sono necessari ulteriori studi per valutare il ruolo di S. epidermidis nella patogenesi dell’AD e la natura della relazione tra S. aureus e S. epidermidis nelle lesioni da AD.
Naik et al. dimostrato che la colonizzazione di S. epidermidis in topi adulti induce una risposta delle cellule T specifica per la pelle (Naik et al., 2015). In questo studio, il gruppo ha applicato ~5 ml di 107-109 CFU per ml di S., epidermidis su tutta la superficie della pelle del mouse a giorni alterni per un totale di quattro applicazioni, una procedura con la quale hanno riferito di ottenere una colonizzazione stabile. Le cellule T indotte in questo studio, tuttavia, erano cellule T IL-17A + CD8 + piuttosto che cellule T CD4+, come in Scharschmidt et al. studio (Scharschmidt et al., 2015). Gli autori hanno dimostrato che queste cellule T IL-17A + CD8 + fornivano immunità all’infezione cutanea da C. albicans (Figura 1C); tuttavia, non hanno esaminato se ciò fornisse anche immunità ad altri agenti patogeni, in particolare S. aureus (Naik et al., 2015).,
Sia il Scharschmidt et al. e Naik et al. gli studi hanno esaminato la risposta immunitaria dell’ospite alla colonizzazione di S. epidermidis, ma i loro risultati sono molto diversi. Queste differenze possono essere attribuite alle sfumature nella configurazione dei modelli murini o eventualmente anche agli specifici ceppi di S. epidermidis utilizzati. Nonostante le differenze nei risultati, collettivamente, i due studi hanno dimostrato che la colonizzazione con S. epidermidis induce una risposta adattativa delle cellule T nei topi. Non è chiaro, tuttavia, se tale firma immunitaria alla colonizzazione di S. epidermidis sia osservata anche negli esseri umani.,
Immunità contro S. epidermidis nelle infezioni associate al biofilm
Sono stati condotti pochissimi studi per valutare la risposta immunitaria alle infezioni associate al biofilm contro, specialmente rispetto a S. aureus. La maggior parte di questi studi si è concentrata su S. epidermidis. CONTRO le infezioni associate al biofilm si verificano spesso in pazienti con impianti medici, con S. epidermidis che è la specie più probabile da recuperare (Rogers et al., 2009)., I biofilm sono agglomerati complessi e spazialmente diversi di cellule batteriche racchiuse all’interno di una matrice extracellulare amorfa autoprodotta composta da DNA extracellulare, proteine e polisaccaridi (Otto, 2008). Le infezioni associate al biofilm sono estremamente resistenti al trattamento antibiotico per diversi motivi, tra cui il metabolismo ridotto e la penetrazione ostacolata attraverso la matrice extracellulare (Mah e O’Toole, 2001). Di conseguenza, il trattamento richiede spesso la rimozione chirurgica del dispositivo o del tessuto infetto., Solo negli Stati Uniti, circa 2 miliardi di dollari vengono spesi ogni anno per il trattamento e la gestione delle infezioni correlate agli impianti ortopedici (Darouiche, 2004; Parvizi et al., 2010).
In generale, la risposta immunitaria dell’ospite a un’infezione associata al biofilm di S. epidermidis non è protettiva o sufficiente per eliminare l’infezione. Quindi, la maggior parte delle infezioni associate al biofilm di S. epidermidis sono croniche. La maggior parte degli studi condotti sull’argomento finora sono studi in vitro che hanno confrontato biofilm-grown contro i batteri planctonici. I risultati di diversi studi suggeriscono che S., i biofilm epidermidis inducono attenuazione della funzione fagocitaria e produzione di citochine antinfiammatorie rispetto alle loro controparti planctoniche (Figura 2). Sono stati riportati risultati contrastanti sugli effetti dei biofilm di S. epidermidis sull’attività fagocitaria. Due studi hanno riportato che l’aderenza e la fagocitosi da parte dei neutrofili umani e dei macrofagi primari derivati dai monociti umani sono state significativamente migliorate quando stimolate con batteri cresciuti con biofilm (Heinzelmann et al., 1997; Spiliopoulou et al.,, 2012), mentre altri hanno riferito che il biofilm esopolisaccaride, polisaccaride adesina intercellulare (PIA) (Mack et al., 1996) svolge un ruolo essenziale nell’attenuazione della capacità fagocitaria dei macrofagi peritoneali murini (Shiau e Wu, 1998), J774A.1 macrofagi murini (Schommer et al., 2011), e PMNs umani. Esiste un consenso in letteratura, tuttavia, per quanto riguarda gli effetti del biofilm di S. epidermidis sull’uccisione fagocitaria. Uccisione da parte di macrofagi umani (Spiliopoulou et al., 2012) e PMNs (Vuong et al., 2004; Kristian et al.,, 2008) così come l’uccisione mediata da anticorpi da parte dei leucociti (Cerca et al., 2006) sono fortemente attenuati in presenza di batteri cresciuti con biofilm.
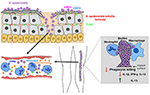
Figura 2. Modello della risposta dell’ospite alle infezioni da S. epidermidis. La violazione attraverso la pelle può provocare la diffusione di S. epidermidis nel flusso sanguigno per causare batteriemia e casi acuti di sepsi., L’immunità ospite contro le infezioni settiche dipende fortemente dai neutrofili, dal complemento e dall’attivazione dei PRRs compresi i recettori accoppiati alla proteina G (GPCR) come TLR2 (verde) e FPR2 (blu). Le infezioni associate al biofilm sugli impianti medici derivano da contaminazioni durante l’inserimento del dispositivo o, in rari casi, dal flusso sanguigno. I pazienti con impianti medici sono sensibili alla sepsi di S. epidermidis, poiché i batteri del biofilm possono spesso diffondersi nel flusso sanguigno., La risposta immunitaria alle infezioni associate al biofilm è generalmente ritenuta non efficace, poiché i biofilm inibiscono l’uccisione fagocitaria da parte di PMNs e macrofagi. Inoltre, inclinano il sistema immunitario verso una maggiore produzione di citochine anti-infiammatorie come IL-13 limitando la secrezione di citochine pro-infiammatorie, tra cui IL1-beta, IL-12 e IFN-gamma.
Il ruolo del complemento nelle infezioni associate al biofilm CONTRO non è abbastanza chiaro. Mentre S., i ceppi produttori di biofilm epidermidis suscitano una risposta più forte nell’attivazione e nel rilascio dei componenti del complemento rispetto alle loro controparti PIA-negative isogene e quindi biofilm-negative (Kristian et al., 2008; Fredheim et al., 2011), tale rilascio di complemento non si è tradotto in una maggiore uccisione fagocitica. I biofilm PIA-positivi di S. epidermidis hanno innescato il rilascio di C3a, ma hanno protetto S. epidermidis dall’opsonizzazione di C3b e IgG e dall’uccisione mediata da PMN (Kristian et al., 2008)., In particolare-mentre alcuni autori hanno cercato di attribuire effetti specifici alla PIA, piuttosto che alla formazione di biofilm, distruggendo meccanicamente gli aggregati (Vuong et al., 2004), in nessuno di questi studi può essere fatta una chiara distinzione tra gli effetti degli agglomerati di biofilm e un effetto diretto dell’esopolisaccaride PIA. Per quanto riguarda le proprietà pro-infiammatorie rivendicate di PIA (Kristian et al., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), i fatti che la PIA è una sostanza difficile da purificare e i mutanti PIA-negativi isogeni hanno proprietà di superficie cellulare nettamente diverse, rende difficile attribuire gli effetti osservati direttamente alla molecola PIA.
È stato riportato che i ceppi coltivati a biofilm di S. epidermidis suscitano la produzione di citochine antinfiammatorie piuttosto che proinfiammatorie (Spiliopoulou et al., 2012). Nel rispettivo studio, macrofagi monociti-derivati umani primari stimolati con S vivi., epidermidis da 24-h biofilm prodotto abbassare i livelli di citochine pro-infiammatorie (IL-1beta, IFN-gamma, IL-12) e di elevati livelli di citochine anti-infiammatorie IL-13 di cellule planctoniche coltivate per 2 h. Ovviamente, in confronto di altri fattori, come la maggior parte in particolare quorum sensing-regolato fattori pro-infiammatori come il fenolo-solubile modulins (PSMs) (Cheung et al., 2014) discusso di seguito, può essere reso responsabile delle differenze osservate piuttosto che della formazione del biofilm stesso., Tuttavia, confrontando i ceppi biofilm-positivi con quelli isogenici biofilm-negativi (PIA-negativi, Embp o Aap-negativi), Schommer et al. ha anche osservato una ridotta risposta infiammatoria nei macrofagi 774A.1 con ridotta attivazione di NF-kappaB e ridotta produzione di IL-1beta (Schommer et al., 2011).
Poco si sa su come il sistema immunitario adattativo risponde alle infezioni associate al biofilm, in parte, perché è difficile stabilire modelli di infezione da biofilm S. epidermidis a lungo termine. Vuong et al. hanno sviluppato un modello di infezione murina catetere-correlati con un S., epidermidis ceppo bioluminescente chiamato SE Xen43, con il quale sono stati in grado di monitorare in tempo reale la progressione dell’infezione associata a S. epidermidis biofilm (Vuong et al., 2008). Confrontando la suscettibilità di Nu / Nu (carente di cellule T) e CBSCBG-MM (carente di cellule T/B) all’infezione associata al biofilm di S. epidermidis con topi Balb/C wild-type immuno-competenti, gli autori hanno scoperto che in particolare i topi Nu/Nu erano più suscettibili all’infezione, indicando un ruolo importante dell’immunità mediata dalle cellule T contro l’infezione associata al biofilm di S. epidermidis.
Immunità contro S., epidermidis durante la sepsi
La presenza di CONTRO nel sangue (batteriemia), spesso originata dalla dispersione di batteri da biofilm su dispositivi medici interni, può causare sepsi acuta (Figura 2). CONTRO la batteriemia è associata a significativi costi sanitari, morbilità e mortalità (Bearman e Wenzel, 2005). I neonati immuno-compromessi e prematuri sono i più vulnerabili alla sepsi CONS con S. epidermidis che è la specie CONS più diffusa coinvolta (Cheung e Otto, 2010).
In contrasto con le infezioni associate al biofilm di S. epidermidis, che sono croniche, S., la sepsi epidermidis è acuta per natura. Pertanto, la risposta immunitaria dell’ospite alla sepsi di S. epidermidis, che si svolge in gran parte nel flusso sanguigno, è molto diversa da quella contro le infezioni associate al biofilm di S. epidermidis che risiedono nei tessuti. Poiché i neonati hanno aumentato la suscettibilità alla sepsi di S. epidermidis, la maggior parte degli studi sulla questione ha riguardato la sepsi neonatale di S. epidermidis. Pertanto, la seguente discussione sarà focalizzata sull’immunità neonatale in risposta alla sepsi di S. epidermidis.,
Un elemento importante nella risposta immunitaria innata sono le cellule immunitarie innate, tra le quali i neutrofili dominano in numero. I neutrofili riconoscono i microbi invasori attraverso un repertorio di recettori ospiti (vedi sotto), li ingeriscono ed li eliminano all’interno del fagosoma da specie reattive dell’ossigeno e proteine antimicrobiche rilasciate durante un processo chiamato degranulazione (Malech et al., 2014). Inoltre, i neutrofili lisati possono formare trappole extracellulari neutrofili (reti) per legare e uccidere i microbi invasori (Brinkmann et al., 2004).,
Diversi recettori di riconoscimento del pattern (PRRs), che riconoscono e si legano ai prodotti microbici conservati (PAMPs, pattern molecolari associati ai patogeni) e svolgono un ruolo essenziale nell’attivazione della risposta immunitaria innata, hanno dimostrato di essere critici nell’immunità dell’ospite contro la sepsi di S. epidermidis. TLR2 è stato dimostrato critico per la clearance di S. epidermidis in un modello di sepsi murina (Strunk et al., 2010). Nei neonati umani, vi è un aumento dell’espressione di TLR2 nel corso della sepsi di S. epidermidis (Viemann et al.,, 2005), tuttavia, un sistema immunitario stimolato da TLR è stato segnalato per essere meno abile nel suscitare risposte multiple di citochine nei neonati rispetto agli adulti (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMS (Hajjar et al., 2001) e acido lipoteichoico (LTA) (Xia et al., 2016) sono stati dichiarati effettori di TLR2. Tuttavia, gli studi con PIA e PSMS non sono stati verificati con mutanti isogeni; e per quanto riguarda LTA, ci sono state prove recenti che indicano che i lipopeptidi stafilococcici piuttosto che LTA sono i veri agenti immunostimolanti (Hashimoto et al., 2006)., Inoltre, in S. aureus è stato dimostrato che i PSM non sono agonisti diretti di TLR2, ma portano al rilascio di lipopeptidi dalla superficie cellulare e quindi hanno un effetto secondario, TLR2-stimolante (Hanzelmann et al., 2016), un effetto probabilmente presente anche in S. epidermidis.
Basato sul fatto che il recettore del peptide formilico 2 (FPR2) riconosce PSMs (Kretschmer et al., 2010), questo recettore chemoattrattante accoppiato alla proteina G è un altro recettore ospite potenzialmente importante nella risposta contro S. epidermidis. Come mostrato in S., aureus, l’attivazione di PSM-FPR2 induce la chemiotassi, l’esocitosi dei granuli e il rilascio di interleuchina-8 (IL-8) da PMNs (Wang et al., 2007; Kretschmer et al., 2010). Gli studi sugli effetti di PSMs di CONTRO sulla risposta immunitaria sono stati eseguiti solo con PSMS puro di S. epidermidis (Cheung et al., 2010), e finora sono stati ostacolati dalla moltitudine di loci psm genetici in S. epidermidis e dalla difficoltà generale di produrre mutanti di delezione isogenica in CONS. Tuttavia, un recente studio ha attribuito un ruolo cruciale al PSM-mec mobile codificato con elementi genetici e altamente prodotto di S., epidermidis nell’infiammazione e nell’evasione immunitaria, utilizzando mutanti isogenici psm-mec (Qin et al., 2017).
Il complemento svolge anche un ruolo importante nell’immunità contro la sepsi di S. epidermidis. Le carenze nel fattore di complemento C3 e nelle IgG sono associate a un rischio più elevato di sepsi neonatale associata al CoNS (Lassiter et al., 1991). Inoltre, in uno studio che utilizza un modello di sepsi del sangue intero ex-vivo, S. epidermidis ha indotto un’attivazione del complemento significativamente inferiore nei neonati rispetto al sangue adulto (Granslo et al., 2013)., Questa scoperta suggerisce che esiste una carenza maturazionale nel sistema del complemento neonatale, che, in parte, può spiegare perché i neonati sono più suscettibili alle infezioni settiche di S. epidermidis rispetto agli adulti. Inoltre, questo studio evidenzia l’importanza del sistema del complemento nella difesa dell’ospite contro la sepsi di S. epidermidis.
Come il complemento, i neutrofili dei neonati pretermine mostrano una carenza maturazionale. Mostrano uno scoppio ossidativo alterato rispetto a quelli isolati dai neonati a termine quando stimolati con S. epidermidis (Björkqvist et al., 2004)., Questo, in parte, può anche spiegare l’aumentata suscettibilità nei neonati pretermine alla sepsi di S. epidermidis. È interessante notare che i monociti, un altro componente cellulare nella risposta immunitaria innata, non sono essenziali per la difesa dell’ospite contro la sepsi neonatale di S. epidermidis poiché entrambi i monociti umani neonatali e adulti hanno mostrato una capacità di uccisione fagocitaria e intracellulare simile (Strunk et al., 2007). Presi insieme, questo indica che i neutrofili svolgono un ruolo particolarmente importante nella risposta immunitaria durante la sepsi di S. epidermidis.,
Mentre ci sono numerosi studi dedicati alla comprensione del ruolo della risposta immunitaria innata durante la sepsi di S. epidermidis, la ricerca sul ruolo della risposta immunitaria adattativa nelle infezioni settiche di S. epidermidis rimane limitata. Poiché queste infezioni sono di natura acuta, è improbabile che la risposta immunitaria adattativa svolga un ruolo significativo. Di conseguenza, il trasferimento endovenoso di immunoglobuline da donatori con alti titoli di anticorpi contro S. epidermidis o S. aureus non è riuscito a proteggere dalla sepsi nei neonati pretermine (Bloom et al., 2005; DeJonge et al., 2007).,
Conclusioni
CoNS le infezioni e in particolare S. epidermidis rappresentano un onere medico ed economico significativo per l’assistenza sanitaria pubblica. Inoltre, con l’emergere della resistenza agli antibiotici, le opzioni di trattamento stanno diventando limitate. Tuttavia, l’eliminazione dei batteri S. epidermidis appare inappropriata, in quanto sono parte integrante del microbiota benefico sulla pelle e sulle mucose.
Il ruolo benefico di S., la colonizzazione di epidermidis nella prevenzione della crescita eccessiva del patogeno sulla pelle, basata sui risultati nei topi, è stata attribuita alla stimolazione della risposta immunitaria. Tuttavia, con il modello di pelle del topo che riflette a malapena la situazione sulla pelle umana, rimane poco chiaro se i risultati siano trasferibili agli esseri umani. Inoltre, resta da studiare se esiste un ruolo di potenziale interazione batterica diretta tra S. epidermidis e agenti patogeni sulla pelle.
La risposta immunitaria a S. epidermidis durante l’infezione è forse ancora meno ben compresa., Nell’infezione cronica associata al biofilm è difficile distinguere tra gli effetti dell’agglomerazione a taglio e quelli mediati da specifici componenti della superficie cellulare. Durante la sepsi, la natura e il ruolo delle citochine proinfiammatorie e delle vie infiammatorie in risposta a S. epidermidis rimangono ugualmente scarsamente definiti. La delucidazione di questi meccanismi fornirà anche ulteriori informazioni sulla domanda perché i neonati sono particolarmente sensibili all’infezione da S. epidermidis. Progressi che sono stati fatti per quanto riguarda gli strumenti di biologia molecolare per S., epidermidis e CONTRO in generale saranno di grande aiuto in questi sforzi e soprattutto aiutare a differenziare tra effetti diretti e secondari. Chiaramente, una comprensione più profonda della risposta immunitaria dell’ospite a queste infezioni sarà fondamentale per lo sviluppo di vaccini S. epidermidis e nuove terapie.
Contributi dell’autore
TN e MO hanno scritto il manoscritto. MP e TN figure preparate.,
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Questo studio è stato supportato dal programma di ricerca intramurale del National Institute of Allergy and Infectious Diseases (NIAID), U. S. National Institutes of Health (NIH), numero di progetto ZIA AI001080.
Kloos, W. E., e Musselwhite, MS (1975)., Distribuzione e persistenza di Staphylococcus e Micrococcus specie e altri batteri aerobici sulla pelle umana. Appl. Microbiolo. 30, 381–385.
PubMed Abstract / Google Scholar















