polimerizare: cum se fac polimerii
îmbinarea unui lanț lung de molecule este cunoscută sub numele de polimerizare.
pentru a păstra lucrurile simple, să ne uităm la un fel de polimerizare numită „polimerizare prin adăugare”. În plus, polimerizarea – ați ghicit-monomerii sunt pur și simplu adăugați împreună într-un model repetat. Acest lucru nu duce la crearea unei alte substanțe suplimentare.
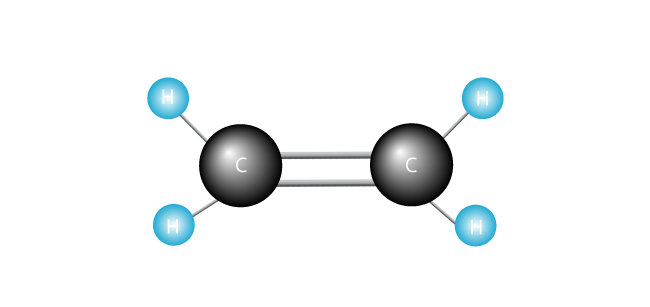
(un alt mod în care polimerii pot fi create se numește polimerizare prin condensare., În acest proces, când fiecare monomer este adăugat la Lanț, o moleculă suplimentară, mică—cum ar fi apa—este creată ca produs secundar. Nylon și poliester sunt făcute în acest fel.polimerizarea adiției se bazează pe un monomer cu o legătură dublă care leagă doi atomi de carbon. Se introduce o moleculă numită radical liber, ceea ce face ca legătura dublă să se deschidă și să se conecteze cu următoarea moleculă de monomer. Lanțul polimeric se formează atunci când aceeași unitate de bază se repetă în mod repetat într-o structură de lanț obișnuită., În timp ce utilizarea radicalilor liberi în acest fel nu este o idee nouă, chimiștii descoperă în mod regulat molecule care sunt mult mai eficiente în fabricarea polimerilor. Aceasta înseamnă că polimerii pot fi făcuți mai rapid, mai ieftin, mai curat și cu un control mai mare al produsului final. să mărim și să analizăm acest proces într-un pic mai detaliat, folosind ca exemplu formarea polietilenei. polietilena este cel mai simplu polimer sintetic. Este alcătuit dintr—un singur tip de monomer-etilenă, care este format din doi atomi de carbon și doi atomi de hidrogen., (Alți polimeri pot fi făcuți din doi sau mai mulți monomeri diferiți.) Polietilena se formează atunci când multe mii de molecule de etilenă sunt unite de la capăt la capăt.procesul începe cu încălzirea unei molecule, cum ar fi peroxidul de hidrogen.
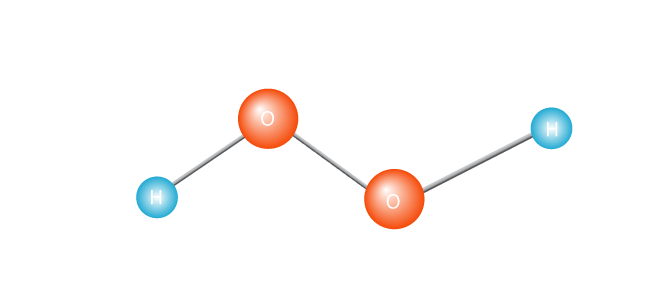
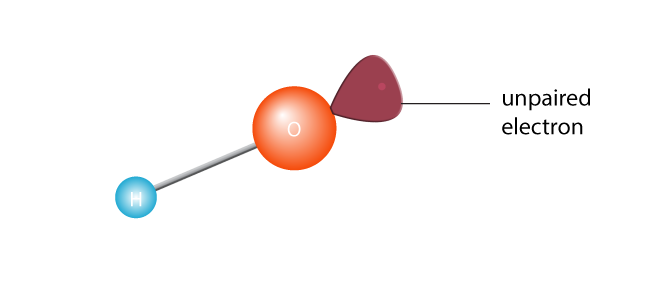
Acest lucru face ca acesta să se scindeze în două, creând un radical liber. Un radical liber este o moleculă cu un singur electron nepereche. Electronii sunt extrovertiții lumii atomice; ei nu fac față cu adevărat să fie singuri., Sau, pentru a deveni tehnic, o moleculă cu un electron nepereche în cochilia sa de valență exterioară este o moleculă instabilă. Oricum, electronul singuratic va dori să se asocieze cu un alt electron.
acum introducem molecula noastră de etilenă.
radicali liberi căutările pentru un alt electron cu care a perechii sale singuratice singur electron.,
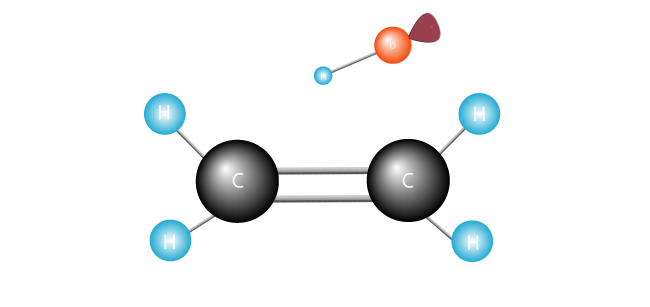
atacă dublu bond, alături de cei doi atomi de carbon în molecula de etilenă și swipes un electron.
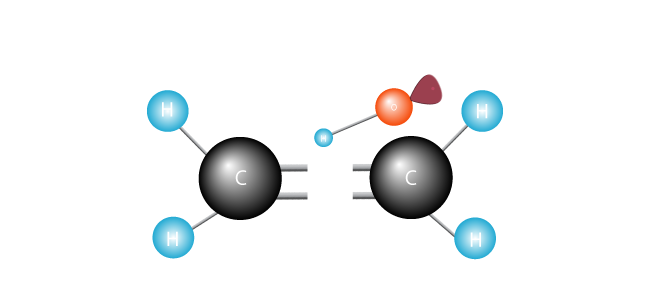
electronii săi se împerechează fericit, radicalul liber se alătură unuia dintre Carboni.celălalt carbon, anterior fericit asociat, are acum un electron nepereche. A devenit un radical liber, cu un electron nepereche dornic să se alăture cu altul pentru a face o pereche.,
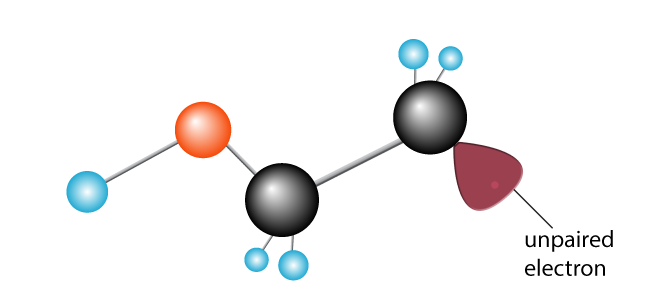
este introdusă o a doua moleculă de etilenă. Radicalul liber Nou creat rupe legătura carbon-carbon, glisând un electron și creând un nou radical liber cu un singur electron nepereche la capăt.
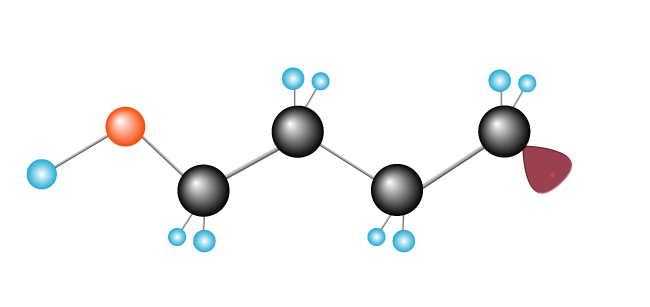
Acest lucru continuă, ca o reacție în lanț, cu un lanț lung de formare cât mai multe molecule de etilenă sunt adăugate.,
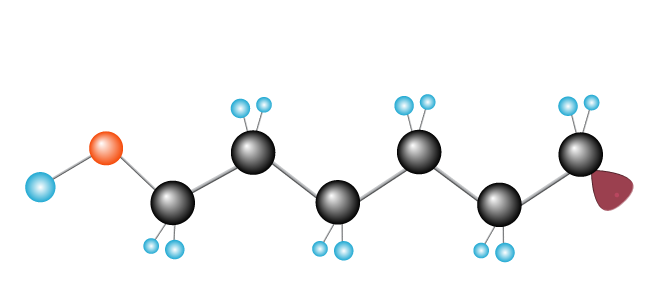
procesul continuă până când radicalii liberi întâlnesc un alt radical liber, completând lanțul.
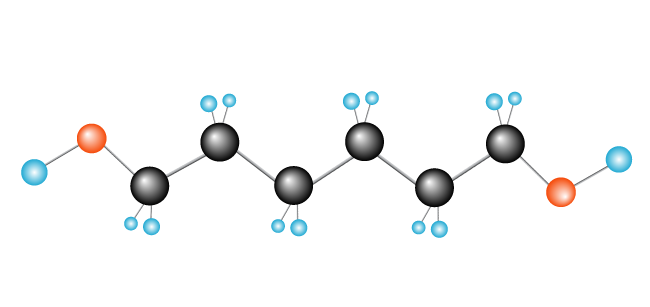
acum avem polimerul nostru, polietilenă, format din monomer (unitate repetitivă) etilenă., alte exemple de polimeri formați în acest mod sunt policloretilena (PVC), utilizată pentru fabricarea țevilor de canalizare și a izolațiilor pentru cablurile electrice, și polipropilena, utilizată în produse precum rațele de cauciuc (și alte jucării) și, atunci când sunt transformate în fibre, covoarele.















