blocurile de proteine sunt aminoacizii, care sunt molecule organice mici care constau dintr-un atom de carbon alfa (central) legat de o grupare amino, o grupare carboxil, un atom de hidrogen și o componentă variabilă numită lanț lateral (vezi mai jos). În cadrul unei proteine, mai mulți aminoacizi sunt legați împreună prin legături peptidice, formând astfel un lanț lung., Legăturile peptidice sunt formate printr-o reacție biochimică care extrage o moleculă de apă, deoarece se alătură grupării amino a unui aminoacid la gruparea carboxil a unui aminoacid vecin. Secvența liniară a aminoacizilor din cadrul unei proteine este considerată structura primară a proteinei.proteinele sunt construite dintr-un set de doar douăzeci de aminoacizi, fiecare având un lanț lateral unic. Lanțurile laterale ale aminoacizilor au chimii diferite. Cel mai mare grup de aminoacizi au lanțuri laterale nepolare., Câțiva alți aminoacizi au lanțuri laterale cu sarcini pozitive sau negative, în timp ce alții au lanțuri laterale polare, dar neîncărcate. Chimia lanțurilor laterale de aminoacizi este esențială pentru structura proteinei, deoarece aceste lanțuri laterale se pot lega între ele pentru a menține o lungime de proteină într-o anumită formă sau Conformație. Lanțurile laterale de aminoacizi încărcate pot forma legături ionice, iar aminoacizii polari sunt capabili să formeze legături de hidrogen. Lanțurile laterale hidrofobe interacționează între ele prin interacțiuni slabe ale van der Waals. Marea majoritate a legăturilor formate de aceste lanțuri laterale sunt necovalente., De fapt, cisteinele sunt singurii aminoacizi capabili să formeze legături covalente, pe care le fac cu lanțurile lor laterale particulare. Datorită interacțiunilor lanțului lateral, secvența și localizarea aminoacizilor într-o anumită proteină ghidează unde apar curburile și pliurile în acea proteină (Figura 1).,
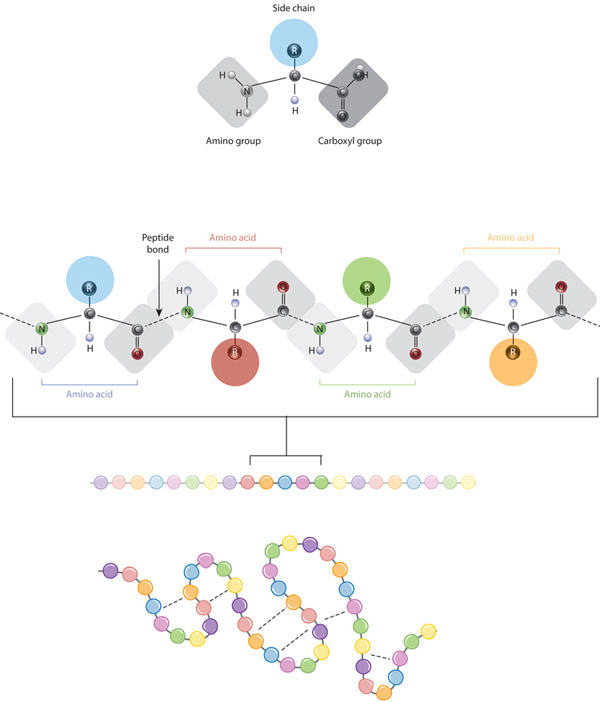
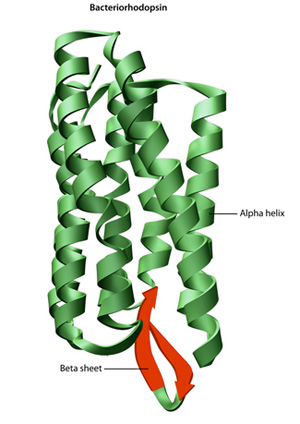
. Legarea hidrogenului între grupările amino și grupările carboxil din regiunile învecinate ale lanțului proteic determină uneori anumite modele de pliere., Cunoscute sub numele de helice alfa și foi beta, aceste modele de pliere stabile alcătuiesc structura secundară a unei proteine. Majoritatea proteinelor conțin mai multe helice și foi, pe lângă alte modele mai puțin frecvente (Figura 2). Ansamblul de formațiuni și pliuri într — un singur lanț liniar de aminoacizi — uneori numit polipeptidă-constituie structura terțiară a unei proteine. În cele din urmă, structura cuaternară a unei proteine se referă la acele macromolecule cu lanțuri sau subunități polipeptidice multiple.,
forma finală adoptată de o proteină nou sintetizată este de obicei cea mai favorabilă din punct de vedere energetic. Pe măsură ce proteinele se pliază, testează o varietate de conformații înainte de a ajunge la forma lor finală, care este unică și compactă. Proteinele pliate sunt stabilizate de mii de legături necovalente între aminoacizi. În plus, forțele chimice dintre o proteină și mediul său imediat contribuie la forma și stabilitatea proteinelor., De exemplu, proteinele care sunt dizolvate în citoplasma celulară au grupuri chimice hidrofile (iubitoare de apă) pe suprafețele lor, în timp ce elementele lor hidrofobe (averse față de apă) tind să fie ascunse în interior. În schimb, proteinele care sunt inserate în membranele celulare prezintă unele grupuri chimice hidrofobe pe suprafața lor, în special în acele regiuni în care suprafața proteinei este expusă lipidelor membranare. Este important de menționat, totuși, că proteinele complet pliate nu sunt înghețate în formă. Mai degrabă, atomii din aceste proteine rămân capabili să facă mișcări mici., chiar dacă proteinele sunt considerate macromolecule, ele sunt prea mici pentru a fi vizualizate, chiar și cu un microscop. Deci, oamenii de știință trebuie să folosească metode indirecte pentru a-și da seama cum arată și cum sunt pliate. Cea mai obișnuită metodă utilizată pentru studierea structurilor proteice este cristalografia cu raze X. Cu această metodă, cristalele solide de proteine purificate sunt plasate într-un fascicul de raze X, iar modelul razelor X deviate este utilizat pentru a prezice pozițiile miilor de atomi din cristalul proteic.















