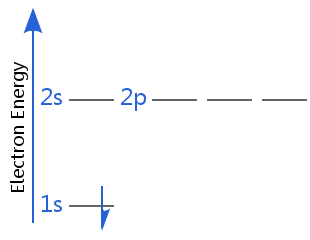原子核、原子、または分子の基底状態は、その最も低いエネルギー状態である。高エネルギー状態は励起状態として記述される。

基底状態は、aの量子化された任意のプロパティに適用されますparticle.In 化学、
•電子基底状態
•振動基底状態
•原子や分子の回転基底状態
それらの励起状態がそうであるように、重要です。,
室温では、ほとんどの分子は電子および振動の基底状態にあり、分子が励起状態に入るためにはより高い温度が必要である。しかし、分子が回転励起状態に入るのに必要なエネルギーは電子または振動励起状態よりも少ないため、ほとんどの分子は室温で励起回転状態にある。
電子基底状態
以下の図は、水素の電子エネルギー準位を示していますatom.In 最初の図では、水素はその電子基底状態にあります。,
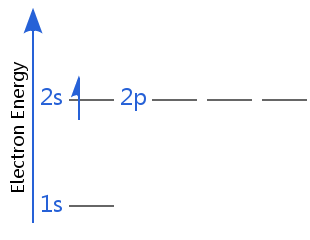
第二の図では、水素の電子はより高いエネルギー殻にあります:水素はもはや電子基底状態になく、励起状態にあります。(水素は、一つの電子を持つ、縮退したサブシェルを持っているので、2sは2pと縮退している-他のすべての原子では、2pサブシェル内の電子は2sよりも高いエネルギーを持っている。
水素の電子がより多くのエネルギーを得た場合、3s、3p、4s、3dなどのようなより高いサブレベルに入ることができる。 これらのすべての場合において、それは励起状態にあるであろう。,
基底状態に戻る
励起状態の粒子は、エネルギーを放出することによって基底状態に戻ることができます。エネルギーは電磁放射の形で失われる。
- 原子または分子中の電子がエネルギーを放出し、基底状態を含むより低いエネルギーのサブレベルに落ちると、エネルギーは可視光または紫外光の形
- 振動エネルギーは、赤外光の放出によって失われる。
- 回転エネルギーは、マイクロ波または遠赤外線の放射によって失われる。,
縮退基底状態
複数の基底状態がある場合、それは複数の最低エネルギー状態があることを意味します。
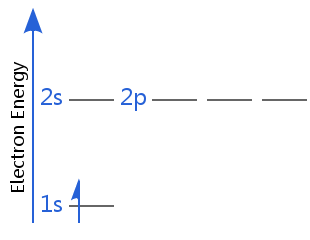
たとえば、以下の図は、次の二つの等しいエネルギー基底状態を示していますhydrogen.In 一方の電子スピンは+πであり、他方の電子スピンは-πである。