Innledning
Coagulase-negative stafylokokker (Ulemper) er en heterogen gruppe av stafylokokk arter klassifisert klinisk ved fravær av blod clotting enzym coagulase. Dette skiller dem fra Staphylococcus aureus og noen klinisk mindre viktig coagulase-positive arter., I dag, Ulemper er den hyppigst isolerte bakterier i klinisk kulturer og har dukket opp som store nosokomiale patogener. Risikofaktorer for Hjerte-infeksjon inkluderer tilstedeværelsen av iboende medisinske implantater, for eksempel intravaskulært kateter, eller immunsuppresjon på grunn av kreft eller HIV/AIDS. Behandling av Ulemper infeksjoner er komplisert av fremveksten av antibiotika-resistente stammer (for eksempel spesielt MRSE, meticillin-resistent S. epidermidis) (Rogers et al., 2009).,
Ulemper er en integrert del av den normale floraen på menneskelig hud og slimhinner, og fortrinnsvis kolonisere fuktige områder (Grice et al., 2009). S. epidermidis, den mest vanlige Ulemper arter utvinnes fra kliniske kulturer, colonizes armhulen, lysken, fremre nares, conjunctiva, tå webs, og perineal-området (verdens nest største og Musselwhite, 1975). Mens vanligvis ufarlige, eller til og med fordelaktig kolonisatorer, når det vert epithelial barrieren er svekket, Ulemper som S. epidermidis kan føre til alvorlige infeksjoner., Faktisk, Ulemper infeksjoner står for det meste av bakteriell sepsis og utenlandske kroppen-relaterte infeksjoner med S. epidermidis å være den mest betydningsfulle arter i den forbindelse (Rogers et al., 2009).
vertens immunrespons mot S. epidermidis, mekanismen av immunsystemet toleranse, og immun fordeler som S. epidermidis commensals kan gi deg, er bare begynnelsen for å bli avslørt. Denne gjennomgangen vil gi deg den nyeste forskning på verten svar til S. epidermidis som commensals, og som opportunistiske bakterier i sammenheng med biofilm og septisk infeksjoner.,
vertens immunrespons mot S. epidermidis som en Commensal
Det er økende bevis for at huden microbiota generelt har en viktig innvirkning på immunsystemet (Belkaid og Tamoutounour, 2016). Til tross for Ulemper som er blant de viktigste hud kolonisatorer, spesifikke studier på vertens immunrespons mot Ulemper kolonisering og etablering har vært begrenset. De som er tilgjengelige har fokusert på immunrespons mot huden kolonisering av prototypical Ulemper arter S. epidermidis og fordeler slik kolonisering gir til verten.,
For eksempel, den Gallo-gruppen har beskrevet potensielt nyttige funksjoner av S. epidermidis som en hud commensal. Nemlig, Lai et al. rapportert at S. epidermidis lipoteichoic syre (LTA) gjennom en mekanisme som involverer TLR (toll-like receptor) 2 reduserer hud betennelse (Lai et al., 2009). De samme forfatterne også senere rapportert at S., epidermidis (men ikke andre bakterier), gir en ikke lenger preget substansen av mindre enn 10 kD som aktiverer TLR2, og dermed induserer antimikrobielle peptid produksjon, noe som økte kapasiteten i celle lysates til å hemme vekst av gruppe A-Streptokokker og S. aureus (Lai et al., 2010) (Figur 1A). Mens disse resultatene understreker en gunstig funksjon av S., epidermidis på huden, om den stimulerende faktor, de må sees i lys av det faktum at det ofte rapportert aktivering av TLR2 av LTA har blitt utfordret: LTA rensing er svært vanskelig, og ofte inneholder TLR2-stimulerende lipopeptide forurensninger, blant annet i kommersielle preparater (Hashimotos et al., 2006). Disse funnene er dermed absolutt krever ytterligere vurdering ved hjelp av isogenic mutanter av S. epidermidis å bekrefte arten av den stimulerende faktor.
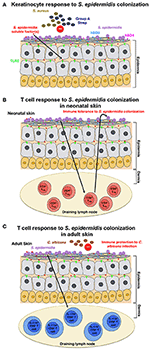
Figur 1., Modell av verten svar til S. epidermidis kolonisering (A) S. epidermidis colonizes huden, epidermis, en svært godt organisert struktur består hovedsakelig av keratinocytes. I respons til S. epidermidis kolonisering, pattern recognition receptors (PRRs) som TLR2 på keratinocytes binde seg til dårlig preget faktor(s) skilles ut av S. epidermidis å stimulere til en signalering cascade at resultater, for eksempel i produksjon av antimikrobielle peptider β-defensin 2 (hBD2) og hBD3. Disse antimikrobielle peptider gi beskyttelse fra kutan S. aureus og Gruppe A-Streptokokk infeksjoner., (B) S. epidermidis kolonisering induserer spesifikke CD4+ FOXP3+ Treg respons, noe som er viktig for immunforsvaret toleranse mot S. epidermidis som en commensal. Immun toleranse er antatt å være etablert bare i den neonatale periode, som kolonisering i voksen mus klart å etablere toleranse. (C) I en annen modell, basert på resultater oppnådd i voksen mus, hud kolonisering av S. epidermidis utløser en bestemt IL-17A+ CD8+ T-celle respons., Primet i huden drenering lymfeknute av CD103+ dendrittiske celler, disse T-cellene forbedre medfødte antimikrobielle forsvar og hindre invasjon av sopp, C. albicans.
Scharschmidt et al. viste at kolonisering med S. epidermidis utløste et lokale, så vel som systemisk, spesifikke CD4+ T-celle respons som demonstrert ved berikelse av spesifikke CD4+ T-celler i både hud-drenerende lymfeknuter og milt (Scharschmidt et al., 2015). Denne gruppen utviklet S., epidermidis huden isolerer, belastning Tü3298, til å uttrykke peptid antigen 2W (Epi-2W) knyttet til en fluorescerende protein. For å oppnå kolonisering, de søkte 108-109 CFUs av konstruert Epi-2W belastning å dorsal hud av C57BL/6-mus hver 3 dager for en sum av tre programmene. Ved hjelp av denne modellen, forfatterne vist at utvidelsen av spesifikke CD4+ regulatoriske T (Treg) celler spiller en avgjørende rolle i immunforsvaret toleranse for S. epidermidis., En slik toleranse, men som kreves for tidlig bakteriell kolonisering i løpet av neonatal scenen, som kolonisering i voksen mus ikke etablere toleranse (Figur 1B). Arbeidet med Scharschmidt et al. er spesielt spennende som det gir den vitenskapelige begrunnelsen for modulering av huden microbiota i den neonatale periode som en terapeutisk alternativ for å behandle inflammatoriske hudsykdommer, og i særdeleshet for atopisk dermatitt (AD).
huden av ANNONSEN pasienter er ofte kolonisert av S. aureus (Higaki et al., 1999). Flere studier viser at S., epidermidis er den nest mest vanlige mikrobe er isolert fra AD-påvirket hud lesjoner (Hon et al., 2005, 2012, 2016). Selv om dette ikke er direkte implisert S. epidermidis i patogenesen av ANNONSEN, på grunn av sin vanlige og hyppige overflod på huden, i den siste av disse studiene, Hon et al. undersøkt av bakterielle isolater fra 100 AD pasienter og fant at S. epidermidis er til stede i de mest alvorlig AD-påvirket hud lesjoner (Hon et al., 2016). Dermed er det tidligere foreslått antagonistiske forholdet mellom S. epidermidis og S. aureus (Cogen et al., 2010; Iwase et al.,, 2010), gjorde ikke oversett til mindre sykdom i sin studie. Snarere resultatene antydet at S. epidermidis kolonisering er assosiert med mer alvorlig ANNONSE sykdom. Sikkert, videre studier er nødvendige for å vurdere rollen S. epidermidis i ANNONSE patogenesen og arten av forholdet mellom S. aureus og S. epidermidis i ANNONSE lesjoner.
Naik et al. vist at S. epidermidis kolonisering i voksen mus induserer en hud-spesifikke T-celle respons (Naik et al., 2015). I denne studien, gruppe anvendt ~5 ml av 107-109 CFU per ml S., epidermidis over hele musen hudens overflate annenhver dag for en sum av fire programmer, en prosedyre der de rapporterte å oppnå stabil kolonisering. T-celler indusert i denne studien, var imidlertid IL-17A+ CD8+ T-celler snarere enn CD4+ T-celler, som i Scharschmidt et al. – studien (Scharschmidt et al., 2015). Forfatterne viste at disse IL-17A+ CD8+ T-celler gitt immunitet mot kutan C. albicans infeksjon (Figur 1C), men de gjorde ikke undersøke om dette også gir immunitet til andre patogener, særlig S. aureus (Naik et al., 2015).,
Både Scharschmidt et al. og Naik et al. studier undersøkt vertens immunrespons mot S. epidermidis kolonisering, men deres funn er ganske forskjellige. Disse forskjellene kan tilskrives nyansene i oppsett av musen, modeller eller muligens også den spesifikke S. epidermidis stammer brukt. Til tross for forskjellene i resultatene samlet de to studiene viste at kolonisering med S. epidermidis induserer en adaptiv T-celle respons i mus. Det er uklart, men hvis en slik immun signaturen S. epidermidis kolonisering er også observert hos mennesker.,
Immunitet Mot S. epidermidis i Biofilm-Assosierte Infeksjoner
Svært få studier har vært utført for å vurdere immunresponsen til Ulemper biofilm-assosierte infeksjoner, spesielt i forhold til S. aureus. De fleste av disse studiene har fokusert på S. epidermidis. Ulemper biofilm-assosierte infeksjoner forekommer ofte hos pasienter med medisinske implantater, med S. epidermidis er det mest sannsynlig arter som skal gjenopprettes (Rogers et al., 2009)., Biofilm er kompleks romlig ulike byområder av bakterielle celler innelukket i en amorf, egenproduserte ekstracellulære matriks består av ekstracellulære DNA, proteiner og polysakkarider (Otto, 2008). Biofilm-assosierte infeksjoner er ekstremt motstandsdyktig mot antibiotika behandling av flere grunner, inkludert redusert metabolisme og hemmet penetrasjon gjennom den ekstracellulære matrix (Mah og O ‘ Toole, 2001). Derfor, behandling krever ofte kirurgisk fjerning av infisert enheten eller vev., I USA alene, ca $ 2 milliarder kroner brukes årlig for behandling og håndtering av ortopediske implantater-relaterte infeksjoner (Darouiche, 2004; Parvizi et al., 2010).
generelt, vert immunrespons til en S. epidermidis biofilm-forbundet infeksjon er ikke beskyttende eller tilstrekkelig for å fjerne infeksjonen. Derfor, de fleste S. epidermidis biofilm-assosierte infeksjoner er kronisk. De fleste studier som er gjort på emnet så langt er in-vitro studier som har sammenlignet biofilm-vokst versus planktoniske bakterier. Resultater fra flere studier tyder på at S., epidermidis biofilm dannes demping i phagocytic funksjon og produksjon av anti-inflammatoriske cytokiner i forhold til deres planktoniske kolleger (Figur 2). Motstridende funn har blitt rapportert om effekter av S. epidermidis biofilm på phagocytic aktivitet. To studier rapporterte at tilslutning og phagocytosis av menneskelig neutrofiler og primære menneskelige monocytt-avledet makrofager ble betydelig forbedret ved stimulering med biofilm dyrket bakterier (Heinzelmann et al., 1997; Spiliopoulou et al.,, 2012), mens andre rapporterte at biofilm exopolysaccharide, polysakkarid intercellulær adhesin (PIA) (Mack et al., 1996) spiller en viktig rolle i reduksjon av phagocytic kapasitet på murin peritoneal makrofager (Shiau og Wu, 1998), J774A.1 murin makrofager (Schommer et al., 2011), og human PMNs. Det er enighet i litteraturen, men med hensyn til virkninger av S. epidermidis biofilm på phagocytic å drepe. Drap av menneskelig makrofager (Spiliopoulou et al., 2012) og PMNs (Vuong et al., 2004; Kristian et al.,, 2008) så vel som antistoff-mediert drap av leukocytter (Cerca et al., 2006), er sterkt svekket i nærvær av biofilm dyrket bakterier.
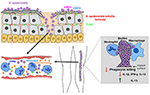
Figur 2. Modell av verten svar til S. epidermidis infeksjoner. Bryter gjennom huden kan resultere i S. epidermidis formidling i blodet til å føre bakterier og akutte tilfeller av sepsis., Vert immunitet mot septisk infeksjoner sterkt avhengig av neutrofiler, utfylle, samt aktivering av PRRs inkludert G-protein koblede reseptorer (GPCRs) som TLR2 (grønn) og FPR2 (blå). Biofilm-assosierte infeksjoner på medisinske implantater stammer fra smitte under enhet innsetting eller, i sjeldne tilfeller, fra blodet. Pasienter med medisinske implantater er utsatt for S. epidermidis sepsis, som biofilm bakterier kan ofte spre inn i blodbanen., Immunforsvaret til biofilm-assosierte infeksjoner er generelt antatt å ikke være effektive, så biofilm hemme phagocytic drap ved PMNs og makrofager. I tillegg, de skew immunforsvaret mot forbedret produksjon av anti-inflammatoriske cytokiner som IL-13, samtidig som du begrenser utskillelsen av pro-inflammatoriske cytokiner, inkludert IL1-beta, IL-12 og IFN-gamma.
Den rollen utfyller Ulemper i biofilm-assosierte infeksjoner er ganske uklart. Mens S., epidermidis biofilm-produserende stammer lokke fram en sterkere respons på aktivering og utslipp av utfylle komponenter enn sine isogenic PIA-negative, og dermed biofilm-negative kolleger (Kristian et al., 2008; Fredheim et al., 2011), slik utfyller slipper ikke oversette til økt phagocytic å drepe. S. epidermidis PIA-positive biofilm utløst C3a utgivelsen, men beskyttet S. epidermidis fra C3b og IgG opsonization og PMN-mediert å drepe (Kristian et al., 2008)., Særlig vil—mens noen forfattere forsøkt å tillegge spesifikke effekter til PIA, snarere enn dannelsen av biofilm, ved mekanisk ødelegge aggregater (Vuong et al., 2004), i ingen av disse studiene et klart skille mellom effekter av biofilm tettbebyggelser og en direkte effekt av exopolysaccharide PIA kan gjøres. Som for hevdet pro-inflammatoriske egenskaper av PIA (Kristian et al., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), fakta at PIA er vanskelig å rense stoff og isogenic PIA-negative mutanter har svært ulike celleoverflaten egenskaper, gjør det vanskelig å tilskrive observerte virkninger direkte til PIA molekyl.
Det har blitt rapportert at S. epidermidis biofilm-vokst stammer lokke fram produksjon av anti-inflammatorisk snarere enn pro-inflammatoriske cytokiner (Spiliopoulou et al., 2012). I den aktuelle studien, primære menneskelige monocytt-avledet makrofager stimulert med live S., epidermidis fra 24-h biofilm produsert lavere nivåer av pro-inflammatoriske cytokiner (IL-1beta, IFN-gamma -, IL-12) og forhøyede nivåer av anti-inflammatorisk cytokin IL-13 enn planktoniske celler dyrket for 2 h. Åpenbart, i den sammenligningen andre faktorer, som særlig tolv-sensing regulert av pro-inflammatoriske faktorer som for eksempel fenol-løselig modulins (PSMs) (Cheung et al., 2014) som omtales nedenfor, kan bli gjort ansvarlig for den observerte forskjeller snarere enn dannelsen av biofilm i seg selv., Men å sammenligne biofilm-positive med isogenic biofilm-negative (PIA-negative, Embp, eller Aap-negative) stammer, Schommer et al. også observert en redusert inflammatorisk respons i 774A.1 makrofager med redusert NF-kappaB aktivering og redusert IL-1beta produksjon (Schommer et al., 2011).
Lite er kjent om hvordan det adaptive immunforsvaret reagerer på biofilm-assosierte infeksjoner, delvis fordi det er vanskelig å etablere langsiktige S. epidermidis biofilm infeksjon modeller. Vuong et al. har utviklet et kateter-relaterte murin infeksjon modell med en S., epidermidis bioluminescent stamme kalt SE Xen43, som de var i stand til å overvåke i sanntid progresjon av S. epidermidis biofilm-forbundet infeksjon (Vuong et al., 2008). Sammenligning av mottakelighet av Nu/Nu (T celle-mangelfull) og CBSCBG MM (T/B-celle-mangelfull) til S. epidermidis biofilm-forbundet infeksjon med immuno-kompetente wild-type Balb/C mus, forfatterne fant at særlig Nu/Nu mus er mer utsatt for infeksjon, noe som indikerer en viktig rolle av T-celle-mediert immunitet mot S. epidermidis biofilm-forbundet infeksjon.
Immunitet Mot S., epidermidis under Sepsis
tilstedeværelsen av Ulemper i blodet (bakterier), ofte stammer fra spredning av bakterier fra biofilm på iboende medisinsk utstyr, kan føre til akutt sepsis (Figur 2). Ulemper bakterier er forbundet med betydelige helsekostnader, sykelighet og dødelighet (Bearman og Wenzel, 2005). Immun-kompromitterte og tidlig neonates er de mest sårbare for Ulemper sepsis med S. epidermidis å være den mest utbredte Ulemper arter som er involvert (Cheung og Otto, 2010).
I motsetning til S. epidermidis biofilm-assosierte infeksjoner, som er kronisk, S., epidermidis sepsis er av akutt karakter. Derfor vert immunrespons mot S. epidermidis sepsis, som foregår i stor grad i blodet, er ganske forskjellig fra mot vev-bosatt S. epidermidis biofilm forbundet-infeksjoner. Siden neonates har økt mottakelighet for S. epidermidis sepsis, de fleste studiene på saken behandlet S. epidermidis neonatal sepsis. Derfor, den følgende diskusjon vil bli fokusert på neonatal immunitet i respons til S. epidermidis sepsis.,
Et viktig element i det medfødte immunforsvaret er medfødt immunceller, som blant neutrofiler dominerer i antall. Neutrofiler gjenkjenne invaderende mikrober via et repertoar av host-reseptorer (se nedenfor), sluker dem, og eliminere dem i phagosome av reaktive oksygen arter og antimikrobielle proteiner utgitt i løpet av en prosess som kalles degranulation (Malech et al., 2014). I tillegg er lysert neutrofiler kan danne nøytrofile ekstracellulære feller (Garn) til å binde og drepe invaderende mikrober (Brinkmann et al., 2004).,
Flere pattern recognition receptors (PRRs), som gjenkjenner og binder seg til et mikrobiell produkter (PAMPs, patogen-associated molecular patterns) og spiller en avgjørende rolle i aktiveringen av det medfødte immunforsvaret, har vist seg å være avgjørende i vert immunitet mot S. epidermidis sepsis. TLR2 ble vist å være viktig for klaring av S. epidermidis i en mus sepsis modell (Strunk et al., 2010). I menneskelige neonates, det er en økning i TLR2 uttrykk i løpet av S. epidermidis sepsis (Viemann et al.,, 2005), men en TLR-stimuleres immunsystemet ble rapportert å være mindre dyktig i å fremmane flere cytokin respons i neonates i forhold til voksne (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001), og lipoteichoic syre (LTA) (Xia et al., 2016) har blitt hevdet å være effektorer av TLR2. Imidlertid, studier med PIA og PSMs ble ikke verifisert med isogenic mutanter, og som for LTA, det har vært de siste bevis som indikerer at stafylokokk lipopeptides snarere enn LTA er den virkelige immun-stimulerende midler (Hashimotos et al., 2006)., Videre, i S. aureus det ble vist at PSMs er ikke direkte agonister av TLR2, men føre til utslipp av lipopeptides fra celleoverflaten og har dermed en sekundær, TLR2-stimulerende effekt (Hanzelmann et al., 2016), en effekt som trolig også til stede i S. epidermidis.
Basert på det faktum at formyl peptid reseptor 2 (FPR2) anerkjenner PSMs (Kretschmer et al., 2010), dette G protein-koblede chemoattractant reseptor er et annet potensielt viktig vert reseptor i responsen mot S. epidermidis. Som vist i S., aureus, PSM-FPR2 aktivering induserer chemotaxis, granulater exocytosis, og interleukin-8 (IL-8) utslipp fra PMNs (Wang et al., 2007; Kretschmer et al., 2010). Studier på effekten av PSMs av Innretninger på immunrespons har bare blitt utført med ren PSMs av S. epidermidis (Cheung et al., 2010), og så langt har vært hemmet av det mangfold av genetiske psm loci i S. epidermidis og generelle problemer med å produsere isogenic sletting mutanter i CoNS. Men en fersk studie tillagt en avgjørende rolle for mobile genetiske elementer-kodet, svært produsert PSM-mec S., epidermidis i betennelse og immunologiske skatteunndragelser, ved hjelp av isogenic psm-mec mutanter (Qin et al., 2017).
Utfylle spiller også en viktig rolle i immunitet mot S. epidermidis sepsis. Mangler i komplement faktor C3 og IgG er forbundet med en høyere risiko for neonatal Ulemper-forbundet sepsis (Lassiter et al., 1991). Videre, i en studie med en ex-vivo hele blod, sepsis modell, S. epidermidis indusert betydelig lavere komplementaktivering i neonatal i forhold til voksne blod (Granslo et al., 2013)., Dette funnet tyder på at det er en maturational mangel i den neonatale komplement-systemet, noe som delvis kan forklare hvorfor neonates er mer utsatt for S. epidermidis septisk infeksjoner enn voksne. Videre, denne studien understreker betydningen av komplement-systemet i vertens forsvar mot S. epidermidis sepsis.
Som utfyller, neutrofiler for tidlig fødte neonates vise maturational mangel. De viser en svekket oksidativ burst i forhold til de som er isolert fra begrepet nyfødte når stimulert med S. epidermidis (Björkqvist et al., 2004)., Dette, i en del, kan også forklare økt mottakelighet i tidlig fødte neonates til S. epidermidis sepsis. Interessant nok, monocytter, en annen mobil komponent i det medfødte immunforsvaret, er ikke avgjørende for å verten forsvar mot neonatal S. epidermidis sepsis som både menneskelige neonatal og voksne monocytter vist lignende phagocytic og intracellulære å drepe kapasitet (Strunk et al., 2007). Til sammen indikerer dette at neutrofiler spille en spesielt viktig rolle i immunforsvaret under S. epidermidis sepsis.,
Mens det finnes mange studier dedikert til å forstå rollen av det medfødte immunforsvaret under S. epidermidis sepsis, forskning på deg rollen som den adaptive immunresponsen i S. epidermidis septisk infeksjoner er fortsatt begrenset. Som disse infeksjonene er akutt i naturen, er det lite trolig at den adaptive immunforsvaret spiller en betydelig rolle. Følgelig, intravenøs overføring av immunglobulin fra givere med høye titere av antistoffer mot S. epidermidis eller S. aureus mislyktes i å beskytte fra sepsis i tidlig fødte nyfødte (Bloom et al., 2005; DeJonge et al., 2007).,
Konklusjon
Ulemper infeksjoner og spesielt S. epidermidis utgjøre en betydelig medisinsk og økonomisk byrde for offentlige helsetjenester. Videre, med fremveksten av antibiotika resistens, behandling alternativer blir begrenset. Imidlertid, eliminering av S. epidermidis bakterier vises upassende, siden de er en integrert del av den reelle microbiota på hud og slimhinner.
gunstig rolle i S., epidermidis kolonisering i forebygging av patogen gjengroing på huden, basert på resultater i mus, som har blitt tilskrevet stimulering av immunforsvaret. Men med musen huden modell knapt noe som gjenspeiler situasjonen på menneskelig hud, det er fortsatt dårlig forstått om funnene kan overføres til mennesker. Videre, om det er en rolle av potensielle direkte bakteriell samspillet mellom S. epidermidis og bakterier på huden som gjenstår å bli undersøkt.
immunforsvaret til S. epidermidis under infeksjonen muligens er enda mindre godt forstått., I kronisk, biofilm-forbundet infeksjon det er vanskelig å skille mellom effekter av skjær tettbebyggelse og de formidlet av spesifikke celleoverflaten komponenter. I løpet av sepsis, natur og rollen av pro-inflammatoriske cytokiner og betennelse trasé i respons til S. epidermidis er fortsatt like dårlig definert. Klarlegging av disse mekanismene vil også gi mer informasjon på spørsmålet hvorfor neonates er spesielt utsatt for S. epidermidis infeksjon. Fremgangen som har blitt gjort om molekylærbiologisk verktøy for S., epidermidis og Ulemper generelt vil være til stor hjelp i disse bestrebelser, og spesielt bistå i å skille mellom direkte og sekundære effekter. Klart, en dypere forståelse av vertens immunrespons mot disse infeksjonene vil være avgjørende for utviklingen av S. epidermidis vaksiner og nye behandlingsformer.
Forfatter Bidrag
TN og MO skrev manus. MP og TN utarbeidet tallene.,
interessekonflikt Uttalelse
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
Erkjennelsene
Denne studien ble støttet av Egenutført Forskning Program av National Institute of Allergy og Smittsomme Sykdommer (NIAID), AMERIKANSKE National Institutes of Health (NIH), prosjekt nummer ZIA AI001080.
verdens nest største, W. E., og Musselwhite, M. S. (1975)., Spredning og persistens av Staphylococcus og Micrococcus arter og andre aerobe bakterier på menneskelig hud. Appl. Microbiol. 30, 381-385.
PubMed Abstrakt | Google Scholar















