Polymerisation: hvordan polymerer er laget
bli med opp i en lang kjede av molekyler er kjent som polymerisation.
for Å holde ting enkelt, la oss se på en slags polymerisation kalt «tillegg polymerisation’. I tillegg polymerisation—du gjettet det—monomers er rett og slett lagt sammen i et repeterende mønster. Dette resulterer i ingen andre, mer, stoffet blir opprettet.
(Den andre måten polymerer som kan opprettes, er kalt kondens polymerisation., I denne prosessen, når hver monomer er lagt til kjeden, en ekstra, små molekyler, slik som vann—er opprettet som et biprodukt. Nylon og polyester er laget på denne måten.)
Tillegg polymerisation er avhengig av en monomer med en dobbel binding koble to karbon-atomer. Et molekyl kalt en av frie radikaler som er innført, noe som fører til at dobbeltbindingen å åpne opp og kobling med neste monomer molekyl. Polymer-kjeden former når de samme grunnleggende enhet er gjentatt over og over i en vanlig kjede struktur., Mens du bruker gratis radikaler på denne måten er ikke en ny idé, kjemikere er regelmessig for å oppdage molekyler som er mye mer effektiv på å gjøre polymerer. Dette betyr at polymerer kan gjøres raskere, billigere, renere og med større kontroll på det endelige produktet.
La oss zoome inn og se på denne prosessen i en litt mer detaljert, med dannelsen av polyetylen som et eksempel.
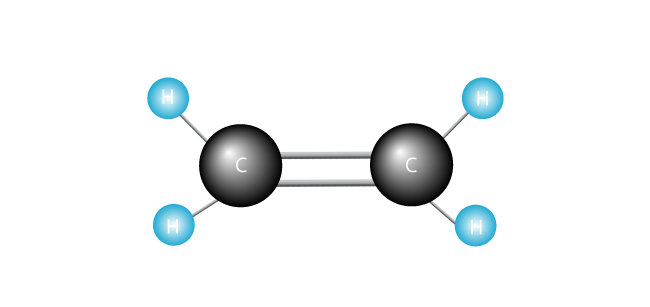
Polyetylen er den enkleste syntetisk polymer. Det består av bare én type monomer—etylen, som er laget av to karbonatomer og to hydrogen atomer., (Andre polymerer kan være laget av to eller flere forskjellige monomers.) Polyetylen er dannet når mange tusenvis av etylen molekyler er satt sammen ende til ende.
prosessen sparkes i gang med oppvarming av et molekyl, for eksempel hydrogen peroxide.
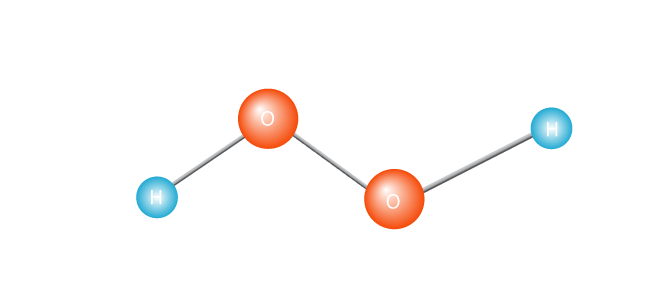
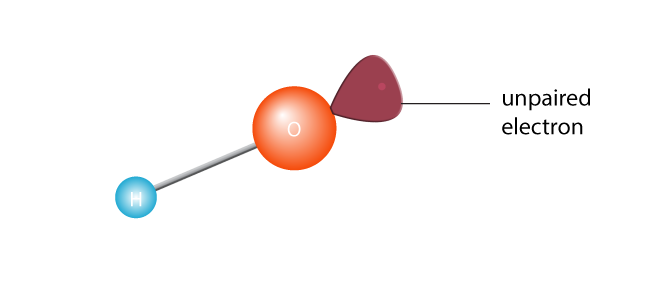
Dette får den til å holde seg i to, for å skape en fri radikal. En fri radikal er et molekyl med en enkelt gruppert elektron. Elektroner er den utadvendte av atom verden; de egentlig ikke takle å være alene., Eller, for å få teknisk, et molekyl med en gruppert elektron i sitt ytterste valence shell er et ustabilt molekyl. Uansett, lone elektronet kommer til å ønske å koble opp med en annen elektron.
Nå lanserer vi vår etylen-molekylet.
fri radikal søker etter en annen electron du vil koble sammen med sin ensomme enkelt elektron.,
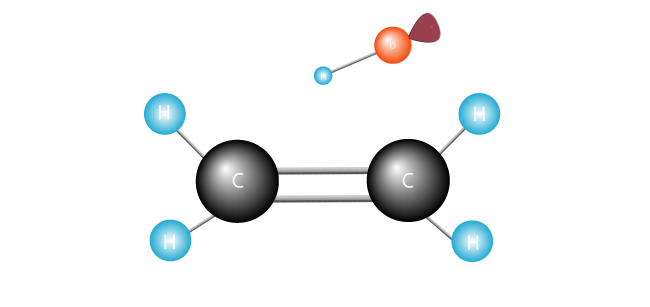
Det angrep dobbeltbindingen bli med de to karbonatomer i etylen-molekylet og avleser et elektron.
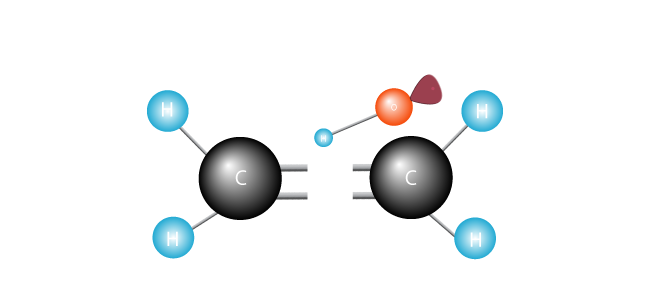
Sine elektroner gjerne koblet opp, den frie radikaler blir en av karbonatomer.
Den andre karbon, tidligere lykkelig sammen, nå har en gruppert elektron. Det har blitt en fri radikal, med en gruppert electron ivrige etter å bli med opp med en annen for å foreta et par.,
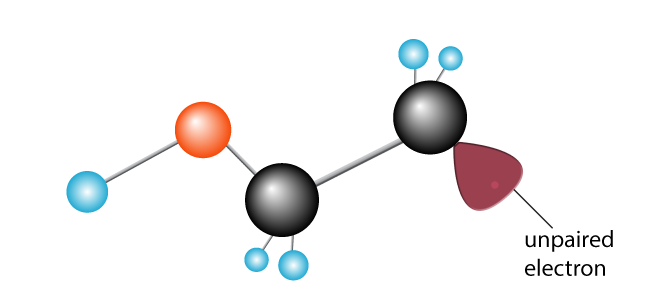
En annen etylen-molekylet er innført. Den nyopprettede frie radikaler bryter karbon-til-karbon bond, dra et elektron, og opprette en ny frie radikaler med et enkelt kort uten par electron på slutten.
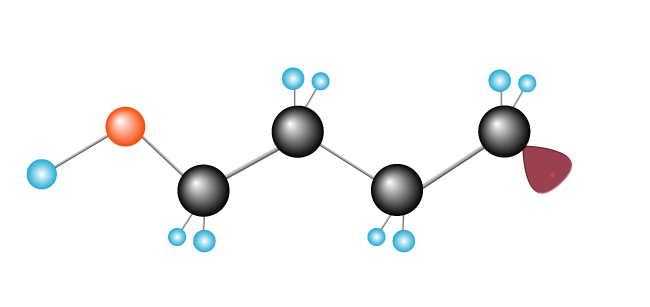
Dette fortsetter, som en kjedereaksjon, med en lang kjede forming som mer etylen-molekyler er lagt til.,
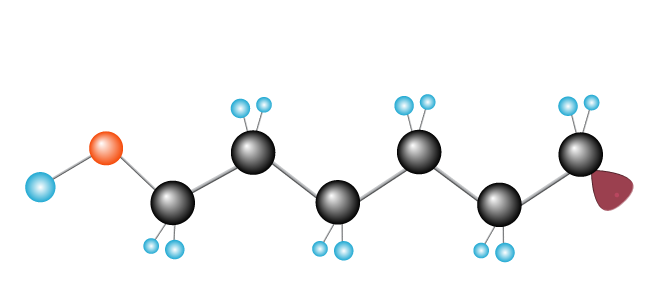
prosessen holder det gående til frie radikaler møter en annen frie radikaler, og fullfører kjeden.
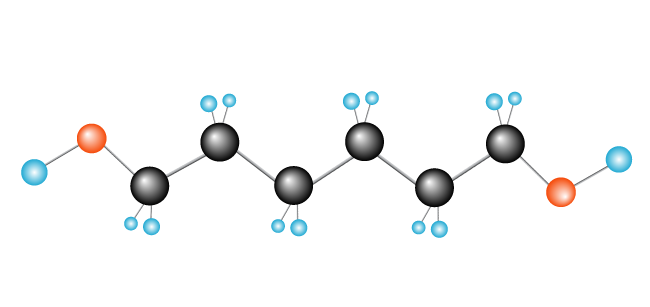
Nå har vi vår polymer, polyetylen, som består av monomer (gjenta enhet) etylen.,
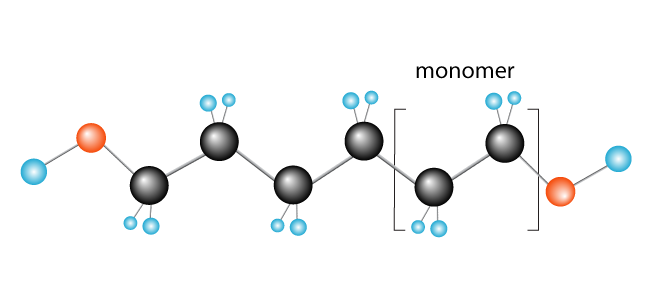
her er Noen andre eksempler av polymerer dannet på denne måten er polychloroethylene (PVC), som brukes til å lage ting som vvs-rør og isolasjon for elektriske kabler, og polypropylen, brukt i produkter som gummi ender (og andre leker) og, når det er behandlet til fibre, tepper.















