byggesteinene i proteiner er aminosyrer, som er små organiske molekyler som består av en alfa (central) karbonatom som er koblet til en amino-gruppe, en carboxyl gruppe, et hydrogenatom, og en variabel komponent som kalles en side kjede (se nedenfor). I et protein, flere aminosyrer er knyttet sammen av peptid obligasjoner, og dermed danner en lang kjede., Peptid obligasjoner er dannet ved en biokjemisk reaksjon som trekker vann molekylet som den møter amino gruppen av en aminosyre til carboxyl gruppe av et nærliggende aminosyre. Lineær sekvens av aminosyrer i et protein som regnes som den primære strukturen av proteinet.
Proteiner er bygd opp av et sett av bare tyve aminosyrene, som hver har en unik side kjede. Siden kjeder av aminosyrer har ulike kjemikalier. Den største gruppen av aminosyrer har upolare sidekjeder., Flere andre aminosyrer har sidekjeder med positive eller negative kostnader, mens andre har polar men ladet sidekjeder. Kjemien av aminosyren sidekjeder er kritisk til protein struktur fordi disse sidekjeder kan bånd med hverandre å holde en lengde av protein i en bestemt form eller konformasjon. Belastet aminosyre sidekjeder kan danne ioniske bindinger, og de polare aminosyrer er i stand til å danne hydrogen obligasjoner. Hydrofobe sidekjeder samhandle med hverandre via svake van der Waals interaksjoner. Det store flertallet av obligasjoner dannet av disse sidekjeder er noncovalent., Faktisk, cysteines er den eneste aminosyrer i stand til å danne covalent obligasjoner, som de gjør med sine spesielle sidekjeder. På grunn av side kjede vekselsvirkningene, rekkefølge og plassering av aminosyrer i et bestemt protein guider, hvor den bøyer seg og kaster seg oppstå i at protein (Figur 1).,
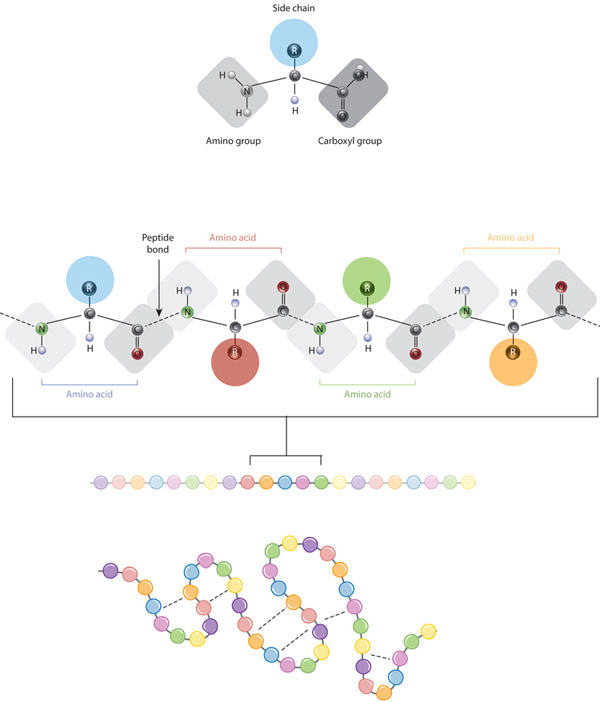
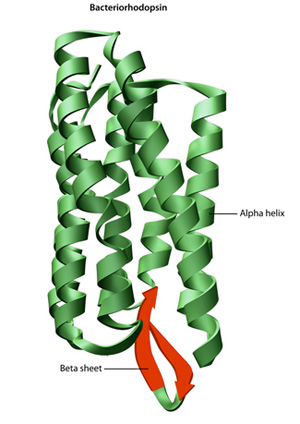
Den primære strukturen til et protein — sin aminosyre — sekvensen- stasjoner folding og intramolecular liming av lineær aminosyre kjede, som til syvende og sist bestemmer protein s unike tre-dimensjonal form. Hydrogenbinding mellom amino grupper og carboxyl grupper i nærliggende områder av protein-kjeden noen ganger fører til at bestemte mønstre av regulerbare til å skje., Kjent som alfa helices-og beta-ark, disse stabil folding mønstre gjøre opp den sekundære strukturen til et protein. De fleste proteiner inneholder flere helices og sengetøy, i tillegg til andre mindre vanlige mønstre (Figur 2). Gruppen av formasjoner og folder i en enkel lineær kjede av aminosyrer — noen ganger kalt et polypeptid — utgjør universitets-strukturen til et protein. Til slutt, kvartære strukturen til et protein som refererer til de makromolekyler med flere polypeptid kjeder eller underenhetene.,
Den endelige formen som er vedtatt av en nylig syntetisert protein er vanligvis den mest energetisk gunstig ett. Som proteiner brett, de tester et utvalg av conformations før den når sin endelige form, som er unike og kompakt. Kastet proteiner er stabilisert av tusenvis av noncovalent båndene mellom aminosyrer. I tillegg, kjemiske krefter mellom protein og dens umiddelbare omgivelser bidra til protein form og stabilitet., For eksempel proteiner som er oppløst i cellenes cytoplasma har hydrofile (vann-elskende) kjemiske grupper på deres overflater, mens deres hydrofobe (vann-uvillig) elementer tendens til å være gjemt inni. I kontrast, proteiner som er satt inn i cellemembranene vise noen hydrofobe kjemiske grupper på overflaten, spesielt i de regionene der protein overflaten er utsatt for membran lipider. Det er viktig å merke seg, men som fullt ut kastet proteiner er ikke frosset i form. Snarere atomer innen disse proteinene være i stand til å gjøre små bevegelser.,
Selv om proteiner er vurdert makromolekyler, de er for små til å visualisere, selv med et mikroskop. Så, forskere må bruke indirekte metoder for å finne ut hva de ser ut og hvordan de er kastet. Den vanligste metoden som brukes for å studere protein strukturer er X-ray crystallography. Med denne metoden, solid krystaller av renset protein er plassert i en X-ray bredde, og mønsteret avledet av X-stråler brukes til å forutsi posisjoner av tusenvis av atomer innen protein-krystall.















