introduktion
Coagulas-negative staphylococci (CoNS) är en heterogen grupp av stafylokockarter klassificerade kliniskt av frånvaron av blodkoagulasenzymkoagulas. Detta skiljer dem från Staphylococcus aureus och några kliniskt mindre viktiga koagulaspositiva arter., Idag är nackdelar de vanligaste isolerade bakterierna i kliniska kulturer och har uppstått som stora nosokomiala patogener. Riskfaktorer för CoNS-infektion inkluderar förekomsten av indwelling medicinska implantat, såsom intravaskulära katetrar, eller immunosuppression på grund av cancerbehandling eller HIV/AIDS. Behandling av CoNS infektioner kompliceras av uppkomsten av antibiotikaresistenta stammar (såsom särskilt MRSE, meticillinresistent S. epidermidis) (Rogers et al., 2009).,
nackdelar är en integrerad del av den normala floran på den mänskliga huden och slemhinnorna och koloniserar företrädesvis fuktiga områden (Grice et al., 2009). S. epidermidis, de vanligaste CoNS-arterna återhämtade sig från kliniska kulturer, koloniserar armhålan, ljummen, främre nares, konjunktiva, tåbanorna och perinealområdet (Kloos och Musselvit, 1975). Medan vanligtvis oskyldiga eller till och med fördelaktiga koloniserare, när värd epitelbarriären äventyras, kan nackdelar som S. epidermidis orsaka allvarliga infektioner., Faktum är att CoNS-infektioner står för majoriteten av bakteriell sepsis och främmande kroppsrelaterade infektioner, med S. epidermidis som den viktigaste arten i det avseendet (Rogers et al., 2009).
värd immunsvaret mot S. epidermidis, mekanismen för immuntolerans och de immunfördelar som S. epidermidis commensals kan ge, börjar bara bli unraveled. Denna översyn kommer att tillhandahålla den senaste forskningen om den mottagande svar till S. epidermidis som commensals, och som opportunistiska bakterier i samband med biofilm och septiska infektioner.,
värd immunsvaret mot S. epidermidis som en Commensal
det finns ökande bevis för att hudmikrobiotan i allmänhet har en viktig inverkan på immunsystemet (Belkaid och Tamoutounour, 2016). Trots nackdelar är bland de viktigaste hud koloniserare, specifika studier på värd immunsvar mot nackdelar kolonisering och etablering har varit begränsad. De som är tillgängliga har fokuserat på immunsvaret mot hudkolonisering av de prototypiska CoNS-arterna S. epidermidis och fördelarna med sådan kolonisering ger värden.,
Gallo-gruppen har till exempel beskrivit potentiellt fördelaktiga funktioner hos S. epidermidis som en hudkommensal. Nämligen lai et al. rapporterade att S. epidermidis lipoteichoic acid (lta) genom en mekanism som involverar TLR (toll-like receptor) 2 minskar hudinflammation (Lai et al., 2009). Samma författare rapporterade också senare att S., epidermidis (men inte andra bakterier) producerar en inte vidare karaktäriserad substans av mindre än 10 kD som aktiverar TLR2 och därigenom inducerar antimikrobiell peptidproduktion, vilket ökade celllysaternas kapacitet att hämma tillväxten av Grupp A streptokocker och S. aureus (Lai et al., 2010) (Figur 1A). Medan dessa resultat understryker en fördelaktig funktion av S., epidermidis på huden, när det gäller den stimulerande faktorn, måste de ses mot bakgrund av det faktum att den ofta rapporterade aktiveringen av TLR2 av LTA har utmanats: lta-rening är extremt svår och innehåller ofta TLR2-stimulerande lipopeptidföroreningar, inklusive i kommersiella preparat (Hashimoto et al., 2006). Dessa fynd kräver därför säkert ytterligare bedömning med hjälp av isogena mutanter av S. epidermidis för att verifiera den stimulerande faktorns natur.
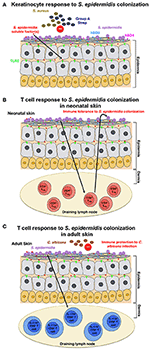
Figur 1., Modell av värd svar på S. epidermidis kolonisering (A) S. epidermidis koloniserar huden epidermis, en mycket organiserad struktur består huvudsakligen av keratinocyter. Som svar på S. epidermidis kolonisering, mönsterigenkänningsreceptorer (PRRs) såsom TLR2 på keratinocyter binder till dåligt karakteriserade faktorer som utsöndras av S. epidermidis att stimulera en signalkaskad som resulterar, till exempel, i produktionen av de antimikrobiella peptiderna β-defensin 2(hBD2) och hBD3. Dessa antimikrobiella peptider ger skydd mot kutan S. aureus och Grupp A Streptococcus infektioner., (B) S. epidermidis kolonisering inducerar ett specifikt CD4+ FOXP3+ Treg-svar, vilket är väsentligt för immuntolerans mot S. epidermidis som commensal. Immuntolerans tros vara etablerad endast under nyföddhetsperioden, eftersom kolonisering hos vuxna möss misslyckades med att fastställa tolerans. (C) i en annan modell, baserat på resultat som erhållits hos vuxna möss, utlöser hudkolonisering av S. epidermidis ett specifikt IL-17A+ CD8+ T-cellsvar., Grundad i huden som dränerar lymfkörteln av CD103 + dendritiska celler, förbättrar dessa T-celler det medfödda antimikrobiella försvaret och förhindrar invasion av svampen, C. albicans.
Scharschmidt et al. visade att kolonisering med S. epidermidis utlöste ett lokalt, såväl som systemiskt, specifikt CD4 + T-cellsvar som demonstreras genom anrikning av specifika CD4 + T-celler i både huddränerande lymfkörtlar och mjälten (Scharschmidt et al., 2015). Denna grupp konstruerade S., epidermidis hudisolat, stam Tü3298, för att uttrycka peptidantigen 2W (Epi-2W) kopplat till ett fluorescerande protein. För att uppnå kolonisering tillämpade de 108-109 CFUs av den konstruerade Epi-2W-stammen till dorsalhuden hos C57BL/6-möss var tredje dag för totalt tre applikationer. Med hjälp av denna modell illustrerade författarna att expansion av specifikt CD4+ regulatory T (Treg) celler spelar en kritisk roll i immuntoleransen mot S. epidermidis., Sådan tolerans krävde emellertid tidig bakteriell kolonisering under neonatalstadiet, eftersom kolonisering hos vuxna möss inte fastställde tolerans (Figur 1b). Arbetet av Scharschmidt et al. är särskilt spännande eftersom det ger den vetenskapliga grunden för modulering av huden microbiota i nyföddhetsperioden som ett terapeutiskt alternativ för att behandla inflammatoriska hudsjukdomar, och i synnerhet för atopisk dermatit (AD).
huden hos AD-patienter koloniseras ofta av S. aureus (Higaki et al., 1999). Flera studier visar att S., epidermidis är den näst vanligaste mikroben isolerad från AD-drabbade hudskador (Hon et al., 2005, 2012, 2016). Även om detta inte direkt implicerar S. epidermidis i patogenesen av AD, på grund av dess normala och frekventa överflöd på huden, i de senaste av dessa studier, Hon et al. undersökte bakteriella isolat från 100 AD-patienter och fann att S. epidermidis är närvarande i de allvarligaste AD-drabbade hudskador (Hon et al., 2016). Således föreslog det tidigare antagonistiska förhållandet mellan S. epidermidis och S. aureus (Cogen et al., 2010; Iwase m.fl.,, 2010), inte översätta till mindre sjukdom i sin studie. Snarare föreslog resultaten att S. epidermidis kolonisering är förknippad med allvarligare AD-sjukdom. Visst krävs ytterligare studier för att utvärdera S. epidermidis roll i Ad-patogenes och arten av förhållandet mellan S. aureus och S. epidermidis i Ad-lesioner.
Naik et al. visat att S. epidermidis kolonisering hos vuxna möss inducerar ett hudspecifikt T-cellsvar (Naik et al., 2015). I denna studie tillämpade gruppen ~5 ml 107-109 CFU per ml S., epidermidis över hela mushudens yta varannan dag för totalt fyra applikationer, ett förfarande genom vilket de rapporterade att få stabil kolonisering. De T-celler som inducerades i denna studie var emellertid IL-17A + CD8 + T-celler snarare än CD4+ T-celler, som i Scharschmidt et al. studie (Scharschmidt et al., 2015). Författarna visade att dessa IL-17A+ CD8+ T-celler under förutsättning immunitet mot kutan C. albicans infektion (Figur 1C), men de gjorde inte undersöka om detta också ger immunitet mot andra patogener, framför allt S. aureus (Naik et al., 2015).,
Både Scharschmidt et al. och Naik et al. studier undersökte värd immunsvaret mot S. epidermidis kolonisering, men deras resultat är ganska olika. Dessa skillnader kan hänföras till nyanserna i inställningen av musmodellerna eller eventuellt även de specifika S. epidermidis-stammarna som används. Trots skillnaderna i resultaten visade kollektivt de två studierna att kolonisering med S. epidermidis inducerar ett adaptivt T-cellsvar hos möss. Det är dock oklart om en sådan immunsignatur mot S. epidermidis kolonisering också observeras hos människor.,
immunitet mot S. epidermidis vid Biofilmrelaterade infektioner
mycket få studier har utförts för att bedöma immunsvaret mot CoNS biofilmrelaterade infektioner, särskilt jämfört med S. aureus. De flesta av dessa studier har fokuserat på S. epidermidis. CoNS biofilmrelaterade infektioner förekommer ofta hos patienter med medicinska implantat, med S. epidermidis är den mest sannolika arten som ska återvinnas (Rogers et al., 2009)., Biofilmer är komplexa, rumsligt olika agglomeringar av bakterieceller inneslutna i en amorf, självproducerad extracellulär matris bestående av extracellulärt DNA, proteiner och polysackarider (Otto, 2008). Biofilmrelaterade infektioner är extremt resistenta mot antibiotikabehandling av flera skäl, inklusive minskad metabolism och hindrad penetration genom den extracellulära matrisen (Mah och O ’ Toole, 2001). Följaktligen kräver behandling ofta kirurgiskt avlägsnande av den infekterade enheten eller vävnaden., Enbart i USA spenderas cirka 2 miljarder dollar årligen för behandling och hantering av ortopediska implantatrelaterade infektioner (Darouiche, 2004; Parvizi et al., 2010).
i allmänhet är värd immunsvaret mot en S. epidermidis biofilmrelaterad infektion inte skyddande eller tillräcklig för att rensa infektionen. Därför är de flesta S. epidermidis biofilmrelaterade infektioner kroniska. De flesta studier som hittills genomförts i ämnet är in vitro-studier som har jämfört biofilmvuxna mot planktoniska bakterier. Resultat från flera studier tyder på att S., epidermidis biofilmer inducerar dämpning i fagocytisk funktion och produktion av antiinflammatoriska cytokiner jämfört med deras planktoniska motsvarigheter (Figur 2). Motstridiga fynd har rapporterats om effekterna av S. epidermidis biofilmer på fagocytisk aktivitet. Två studier rapporterade att vidhäftning och fagocytos av humana neutrofiler och primära humana monocyt-härledda makrofager förbättrades signifikant när de stimulerades med biofilmvuxna bakterier (Heinzelmann et al., 1997; Spiliopoulou et al.,, 2012), medan andra rapporterade att biofilm exopolysackarid, polysackarid intercellulärt adhesin (PIA) (Mack et al., 1996) spelar en viktig roll i dämpningen av fagocytisk kapacitet hos murina peritoneala makrofager (Shiau och Wu, 1998), J774A.1 murina makrofager (Schommer et al., 2011), och mänskliga PMNs. Det finns dock enighet i litteraturen när det gäller effekterna av S. epidermidis biofilm på fagocytisk dödande. Dödande av mänskliga makrofager (Spiliopoulou et al., 2012) och PMNs (Vuong et al., 2004; Kristian m.fl.,, 2008) samt antikroppsmedierad dödande av leukocyter (Cerca et al., 2006) dämpas starkt i närvaro av biofilmvuxna bakterier.
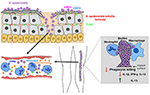
Figur 2. Modell av värd svar på S. epidermidis infektioner. Brott genom huden kan resultera i S. epidermidis spridning i blodomloppet för att orsaka bakteriemi och akuta fall av sepsis., Värd immunitet mot septiska infektioner beror kraftigt på neutrofiler, komplement, samt aktivering av PRR inklusive g-protein kopplade receptorer (GPCRs) såsom TLR2 (grön) och fpr2 (blå). Biofilmrelaterade infektioner på medicinska implantat härrör från föroreningar under införandet av anordningen eller, i sällsynta fall, från blodomloppet. Patienter med medicinska implantat är mottagliga för S. epidermidis sepsis, eftersom biofilmbakterier ofta kan sprida sig i blodet., Immunsvaret mot biofilmrelaterade infektioner anses i allmänhet inte vara effektivt, eftersom biofilmer hämmar fagocytiskt dödande av PMNs och makrofager. Dessutom skyr de immunsystemet mot förbättrad produktion av antiinflammatoriska cytokiner som IL-13 samtidigt som de begränsar utsöndringen av proinflammatoriska cytokiner, inklusive IL1-beta, IL-12 och IFN-gamma.
komplementets roll i CoNS biofilm-associerade infektioner är ganska oklart. Medan S., epidermidis biofilmproducerande stammar framkallar ett starkare svar vid aktivering och frisättning av komplementkomponenter än deras isogena PIA-negativa och därmed biofilm-negativa motsvarigheter (Kristian et al., 2008; Fredheim et al., 2011), en sådan komplementsläpp inte översätta till förbättrad fagocytisk dödande. S. epidermidis PIA-positiva biofilmer utlöste C3A-frisättning, men skyddade S. epidermidis från C3B och IgG opsonisering och PMN-medierad dödande (Kristian et al., 2008)., Särskilt-medan vissa författare försökte tillskriva specifika effekter till PIA, snarare än biofilmbildning, genom att mekaniskt förstöra aggregat (Vuong et al., 2004), i ingen av dessa studier kan man göra en tydlig åtskillnad mellan effekterna av biofilms tätbebyggelse och en direkt effekt av exopolysackaridpia. När det gäller de påstådda pro-inflammatoriska egenskaperna hos PIA (Kristian et al., 2008; Fredheim et al., 2011; Ferreirinha et al.,, 2016), de fakta som PIA är en svår att rena substans och isogena PIA-negativa mutanter har tydligt olika cellytegenskaper, gör det svårt att tillskriva observerade effekter direkt till PIA-molekylen.
det har rapporterats att S. epidermidis biofilm-odlade stammar framkallar produktion av antiinflammatoriska snarare än pro-inflammatoriska cytokiner (Spiliopoulou et al., 2012). I respektive studie stimulerade primära humana monocyt-härledda makrofager med levande S., epidermidis från 24-h biofilmer producerade lägre nivåer av proinflammatoriska cytokiner (IL-1beta, IFN-gamma, IL-12) och förhöjda nivåer av de antiinflammatoriska cytokin IL-13 än planktoniska celler odlade för 2 h. självklart, i den jämförelsen andra faktorer, såsom framför allt kvorum-sensing-reglerade proinflammatoriska faktorer som fenollösliga modulin (PSMS) (Cheung et al., 2014) diskuteras nedan, kan göras ansvarig för de observerade skillnaderna snarare än biofilmbildning själv., Att jämföra biofilm-positiv med isogen biofilm-negativ (Pia-negativ, Embp eller AAP-negativ) stammar, Schommer et al. observerade också ett minskat inflammatoriskt svar i 774A. 1 makrofager med minskad NF-kappabaktivering och minskad IL-1beta-produktion (Schommer et al., 2011).
Lite är känt om hur det adaptiva immunsystemet svarar på biofilmrelaterade infektioner, delvis eftersom det är svårt att fastställa långsiktiga S. epidermidis biofilminfektionsmodeller. Vuong et al. har utvecklat en kateterrelaterad Murin infektion modell med en S., epidermidis Bioluminescent stam kallas se Xen43, med vilken de kunde övervaka i realtid utvecklingen av S. epidermidis biofilm-associerad infektion (Vuong et al., 2008). Att jämföra känsligheten hos Nu / Nu (t-cellbrist) och CBSCBG-MM (t/b-cellbrist) till S. epidermidis biofilm-associerad infektion med immuno-kompetenta wild-type Balb/c-möss, fann författarna att i synnerhet nu/Nu-mössen var mer mottagliga för infektion, vilket indikerar en viktig roll för t-cellmedierad immunitet mot S. epidermidis biofilm-associerad infektion.
immunitet mot S., epidermidis under Sepsis
närvaron av nackdelar i blodet (bakteriemi), som ofta härrör från spridningen av bakterier från biofilmer på indwelling medicintekniska produkter, kan orsaka akut sepsis (Figur 2). Nackdelar bakteriemi är förknippad med betydande sjukvårdskostnader, sjuklighet och dödlighet (Bearman och Wenzel, 2005). Immun-komprometterade och för tidiga nyfödda är de mest utsatta för CoNS sepsis med S. epidermidis som den vanligaste CoNS-arten som är inblandad (Cheung och Otto, 2010).
i motsats till S. epidermidis biofilmrelaterade infektioner, som är kroniska, S., epidermidis sepsis är akut av naturen. Därför värd immunsvaret mot S. epidermidis sepsis, som äger rum i stor utsträckning i blodet, är helt annorlunda än den mot vävnads-bosatt S. epidermidis biofilm associerad-infektioner. Eftersom nyfödda har ökad känslighet för S. epidermidis sepsis, behandlade de flesta studierna i frågan S. epidermidis neonatal sepsis. Därför kommer följande diskussion att inriktas på neonatal immunitet som svar på S. epidermidis sepsis.,
ett viktigt element i det medfödda immunsvaret är medfödda immunceller, bland vilka neutrofiler dominerar i antal. Neutrofiler känner igen invaderande mikrober via en repertoar av värdreceptorer (se nedan), äter dem och eliminerar dem inom fagosomen av reaktiva syrearter och antimikrobiella proteiner som frigörs under en process som kallas degranulering (Malech et al., 2014). Dessutom kan lyserade neutrofiler bilda neutrofila extracellulära fällor (nät) för att binda och döda invaderande mikrober (Brinkmann et al., 2004).,
flera mönsterigenkänningsreceptorer (PRRs), som känner igen och binder till konserverade mikrobiella produkter (PAMPs, patogenassocierade molekylära mönster) och spelar en viktig roll vid aktiveringen av det medfödda immunsvaret, har visat sig vara kritiska i värdimmunitet mot S. epidermidis sepsis. TLR2 visat sig vara avgörande för avslutande av S. epidermidis i en mus sepsis modell (Strunk et al., 2010). Hos humana nyfödda finns en ökning av TLR2-uttrycket under loppet av S. epidermidis sepsis (viemann et al.,, 2005), men ett TLR-stimulerat immunsystem rapporterades vara mindre kunnig i att framkalla flera cytokin svar hos nyfödda jämfört med vuxna (Kollmann et al., 2009). S. epidermidis PIA (Stevens et al., 2009), PSMs (Hajjar et al., 2001), och lipoteichoesyra (lta) (Xia et al., 2016) har hävdats vara EFFEKTORS av TLR2. Studier med PIA och PSM verifierades emellertid inte med isogena mutanter; och när det gäller lta har det förekommit nya bevis som indikerar att stafylokock lipopeptider snarare än LTA är de verkliga immunstimulerande agenterna (Hashimoto et al., 2006)., Vidare visades det i S. aureus att PSM inte är direkta agonister av TLR2, men leder till frisättning av lipopeptider från cellytan och därmed har en sekundär TLR2-stimulerande effekt (Hanzelmann et al., 2016), en effekt som sannolikt också förekommer i S. epidermidis.
baserat på det faktum att formylpeptidreceptorn 2 (FPR2) känner igen PSMs (Kretschmer et al., 2010), denna G proteinkopplade kemoattraktantreceptor är en annan potentiellt viktig värdreceptor i svaret mot S. epidermidis. Som visas i S., aureus, PSM-FPR2 aktivering inducerar kemotaxi, granulat exocytos, och interleukin-8 (IL-8) frisättning från PMNs (Wang et al., 2007; Kretschmer et al., 2010). Studier av effekterna av PSMS av CoNS på immunsvaret har endast utförts med rena PSMS av S. epidermidis (Cheung et al., 2010), och hittills har hindrats av mängden genetiska PSM loci i S. epidermidis och den allmänna svårigheten att producera isogena deletionsmutanter I nackdelar. Men en nyligen genomförd studie tillskrivs en avgörande roll för den mobila genetiska-element-kodade, högproducerade PSM-mec av S., epidermidis i inflammation och immunflytande, med användning av isogena PSM-mec-mutanter (Qin et al., 2017).
komplement spelar också en viktig roll i immuniteten mot S. epidermidis sepsis. Brister i komplementfaktor C3 och IgG är förknippade med en högre risk för neonatal Konsassocierad sepsis (Lassiter et al., 1991). Vidare inducerade S. epidermidis i en studie med en ex-vivo helblods sepsismodell signifikant lägre komplementaktivering hos neonatal jämfört med vuxenblod (Granslo et al., 2013)., Detta fynd tyder på att det finns en mognadsbrist i det neonatala komplementsystemet, vilket delvis kan förklara varför nyfödda är mer mottagliga för S. epidermidis septiska infektioner än vuxna. Dessutom belyser denna studie vikten av komplementsystemet i värdförsvaret mot S. epidermidis sepsis.
som komplement visar neutrofiler av prematura nyfödda mognadsbrist. De visar en nedsatt oxidativ burst jämfört med de isolerade från nyfödda när de stimuleras med S. epidermidis (Björkqvist et al., 2004)., Detta kan delvis också förklara den ökade känsligheten hos prematura nyfödda till S. epidermidis sepsis. Intressant nog är monocyter, en annan cellulär komponent i det medfödda immunsvaret, inte nödvändiga för värdförsvaret mot neonatal S. epidermidis sepsis, eftersom både mänskliga neonatala och vuxna monocyter visade liknande fagocytisk och intracellulär dödningskapacitet (Strunk et al., 2007). Tillsammans indikerar detta att neutrofiler spelar en särskilt viktig roll i immunsvaret under S. epidermidis sepsis.,
Även om det finns många studier dedikerade till att förstå rollen av det medfödda immunsvaret under S. epidermidis sepsis, är forskningen om rollen av det adaptiva immunsvaret i S. epidermidis septiska infektioner fortfarande begränsad. Eftersom dessa infektioner är akuta i naturen är det osannolikt att det adaptiva immunsvaret spelar en viktig roll. Följaktligen lyckades intravenös överföring av immunoglobulin från givare med höga titrar av antikroppar mot S. epidermidis eller S. aureus inte skydda mot sepsis hos prematura nyfödda (Bloom et al., 2005; DeJonge m.fl., 2007).,
slutsatser
CoNS infektioner och i synnerhet S. epidermidis utgör en betydande medicinsk och ekonomisk börda för offentlig hälso-och sjukvård. Vidare, med uppkomsten av antibiotikaresistens, behandlingsalternativ blir begränsade. Eliminering av S. epidermidis bakterier verkar emellertid olämpligt, eftersom de är en integrerad del av den fördelaktiga mikrobiotan på huden och slemhinnorna.
S.: S positiva roll, epidermidis kolonisering vid förebyggande av patogen överväxt på huden, baserat på resultat hos möss, har hänförts till stimulering av immunsvaret. Men med mushudmodellen som knappt återspeglar situationen på mänsklig hud, är det fortfarande dåligt förstått om resultaten kan överföras till människor. Vidare återstår att undersöka om det finns en roll av potentiell direkt bakteriell interaktion mellan S. epidermidis och patogener på huden.
immunsvaret mot S. epidermidis under infektion är möjligen ännu mindre väl förstått., Vid kronisk, biofilmrelaterad infektion är det svårt att skilja mellan effekter av skjuv agglomeration och de som medieras av specifika cellytkomponenter. Under sepsis förblir naturen och rollen av proinflammatoriska cytokiner och inflammationsvägar som svar på S. epidermidis lika dåligt definierade. Klarläggande av dessa mekanismer kommer också att ge mer information om frågan varför nyfödda är särskilt mottagliga för S. epidermidis-infektion. Framsteg som har gjorts när det gäller molekylärbiologiska verktyg för S., epidermidis och nackdelar i allmänhet kommer att vara till stor hjälp i dessa strävanden och särskilt hjälpa till att skilja mellan direkta och sekundära effekter. Uppenbarligen kommer en djupare förståelse av värd immunsvaret mot dessa infektioner vara avgörande för utvecklingen av S. epidermidis vacciner och nya terapier.
Författarbidrag
TN och MO skrev manuskriptet. MP och TN beredda siffror.,
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
denna studie stöddes av det intramurala forskningsprogrammet för National Institute of Allergy and Infectious Diseases (NIAID), US National Institutes of Health (NIH), projektnummer ZIA AI001080.
Kloos, W. E., och Musselwhite, M. S. (1975)., Distribution och uthållighet av stafylokocker och Mikrokockusarter och andra aeroba bakterier på mänsklig hud. Appl. Microbiol. 30, 381–385.
PubMed Abstract / Google Scholar















