Polymerisation: hur polymerer tillverkas
sammanfogningen av en lång kedja av molekyler kallas polymerisation.
för att hålla det enkelt, låt oss titta på en typ av polymerisation som kallas ”addition polymerisation”. Dessutom läggs polymerisation—du gissade det—monomerer helt enkelt ihop i ett upprepande mönster. Detta resulterar i att inget annat, ytterligare, ämne skapas.
(det andra sättet på vilket polymerer kan skapas kallas kondenspolymerisering., I denna process, när varje monomer läggs till kedjan, skapas en ytterligare liten molekyl—såsom vatten-som en biprodukt. Nylon och polyester görs på detta sätt.)
Additionspolymerisering bygger på en monomer med en dubbelbindning som förbinder två kolatomer. En molekyl som kallas en fri radikal införs, vilket gör att dubbelbindningen öppnas och kopplas till nästa monomermolekyl. Polymerkedjan bildas när samma grundläggande enhet upprepas om och om igen i en vanlig kedjestruktur., Medan du använder fria radikaler på detta sätt är inte en ny idé, upptäcker kemister regelbundet molekyler som är mycket effektivare vid tillverkning av polymerer. Detta innebär att polymerer kan göras snabbare, billigare, renare och med större kontroll över slutprodukten.
låt oss zooma in och titta på denna process i lite mer detalj, med hjälp av bildandet av polyeten som ett exempel.
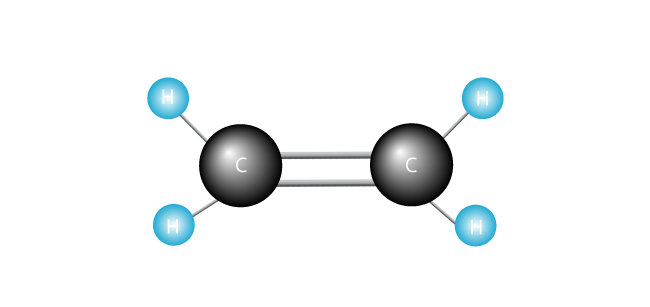
polyeten är den enklaste syntetiska polymeren. Den består av bara en typ av monomer-etylen, som är gjord av två kolatomer och två väteatomer., (Andra polymerer kan tillverkas av två eller flera olika monomerer.) Polyeten bildas när många tusentals etylenmolekyler förenas ände mot ände.
processen startar med uppvärmning av en molekyl, såsom väteperoxid.
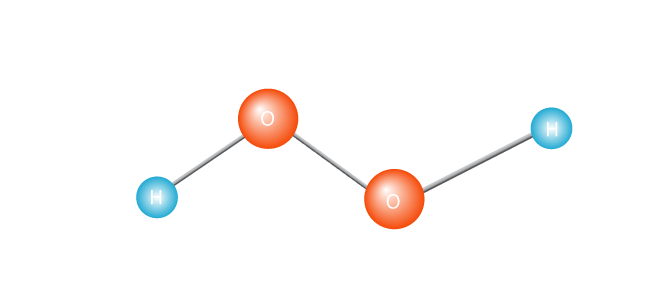
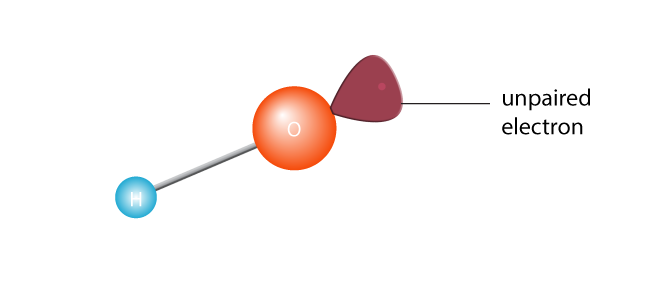
detta gör att den klyvs i två, vilket skapar en fri radikal. En fri radikal är en molekyl med en enda oparad elektron. Elektroner är utåtriktade av atom världen; de verkligen inte klara av att vara ensam., Eller för att få teknisk är en molekyl med en oparad elektron i sitt yttersta valensskal en instabil molekyl. Hursomhelst, den ensamme elektronen kommer att vilja para ihop med en annan elektron.
nu introducerar vi vår etylenmolekyl.
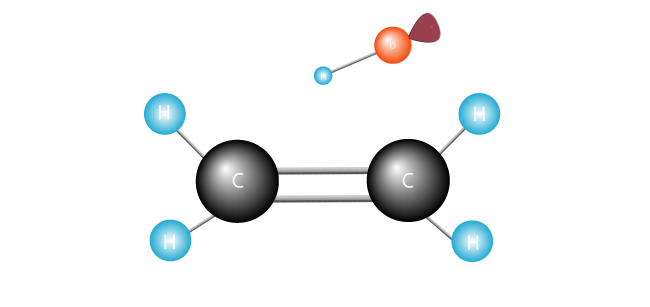
den fria radikalen söker efter en annan elektron för att para ihop sin ensamma enda elektron.,
det angriper dubbelbindningen som förenar de två kolerna i etylenmolekylen och drar en elektron.
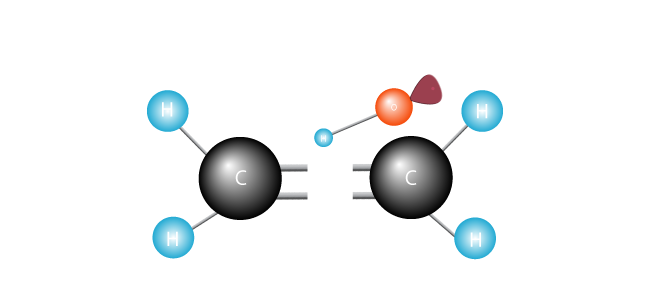
dess elektroner lyckligtvis paras ihop, den fria radikalen förenar en av kolerna.
det andra kolet, tidigare lyckligt parat, har nu en oparad elektron. Det har blivit en fri radikal, med en oparad elektron ivrig att gå med i en annan för att göra ett par.,
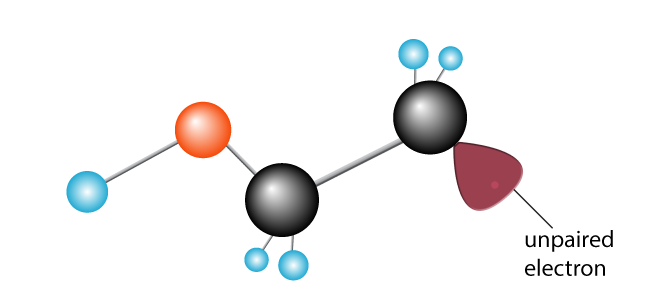
en andra etylenmolekyl införs. Den nyskapade fria radikalen bryter kol-till-kolbindningen, sveper en elektron och skapar en ny fri radikal med en enda oparad elektron i slutet.
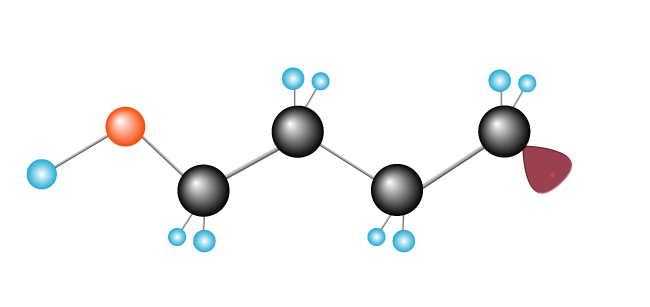
detta fortsätter, som en kedjereaktion, med en lång kedja som bildas när fler etylenmolekyler tillsätts.,
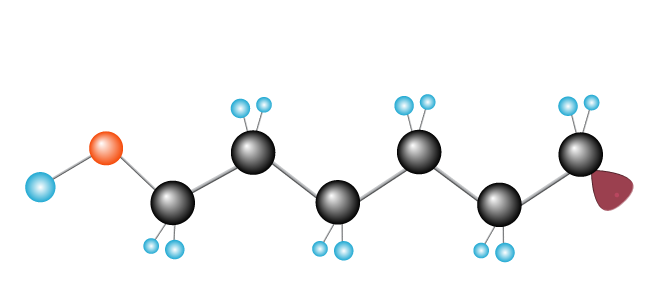
processen fortsätter tills fria radikaler möter en annan fri radikal och fullbordar kedjan.
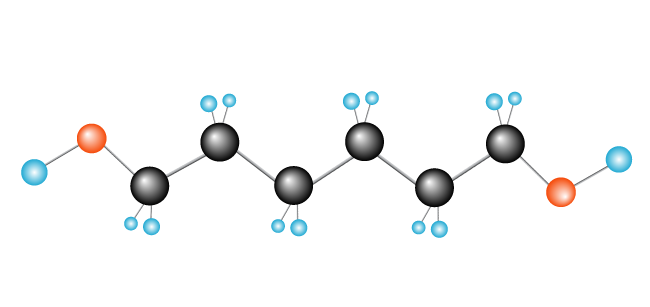
nu har vi vår polymer, polyeten, som består av monomeren (repeterande enhet) etylen.,
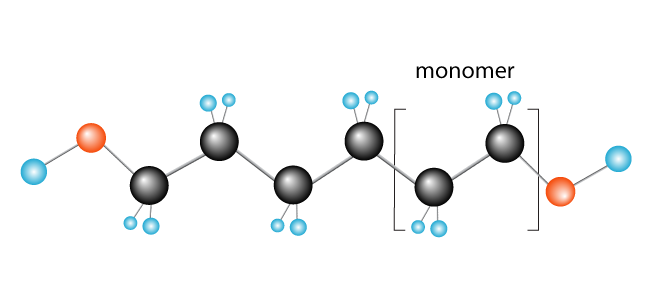
några andra exempel på polymerer som bildas på detta sätt är polykloretylen (PVC), som används för att göra saker som rörledningar och isolering för elektriska kablar och polypropen, som används i produkter som gummiankor (och andra leksaker) och, när de bearbetas till fibrer, mattor.















