byggstenarna av proteiner är aminosyror, vilka är små organiska molekyler som består av en alfa (central) kolatom kopplad till en aminogrupp, en karboxylgrupp, en väteatom och en variabel komponent som kallas en sidokedja (se nedan). Inom ett protein är flera aminosyror kopplade samman av peptidbindningar och bildar därigenom en lång kedja., Peptidbindningar bildas av en biokemisk reaktion som extraherar en vattenmolekyl eftersom den förenar aminogruppen av en aminosyra till karboxylgruppen av en närliggande aminosyra. Den linjära sekvensen av aminosyror inom ett protein anses vara proteinets primära struktur.
proteiner är byggda från en uppsättning av endast tjugo aminosyror, som var och en har en unik sidokedja. Sidokedjorna av aminosyror har olika kemister. Den största gruppen av aminosyror har nonpolära sidokedjor., Flera andra aminosyror har sidokedjor med positiva eller negativa laddningar, medan andra har polära men oladdade sidokedjor. Kemin av aminosyra sidokedjor är avgörande för proteinstrukturen eftersom dessa sidokedjor kan binda med varandra för att hålla en längd av protein i en viss form eller konformation. Laddade aminosyra sidokedjor kan bilda jonbindningar, och polära aminosyror kan bilda vätebindningar. Hydrofoba sidokedjor interagerar med varandra via svaga van der Waals interaktioner. Den stora majoriteten av obligationer som bildas av dessa sidokedjor är noncovalent., Faktum är att cysteiner är de enda aminosyrorna som kan bilda kovalenta bindningar, vilket de gör med sina speciella sidokedjor. På grund av sidokedjans interaktioner, sekvensen och placeringen av aminosyror i ett visst protein guider där böjar och veck förekommer i det proteinet (Figur 1).,
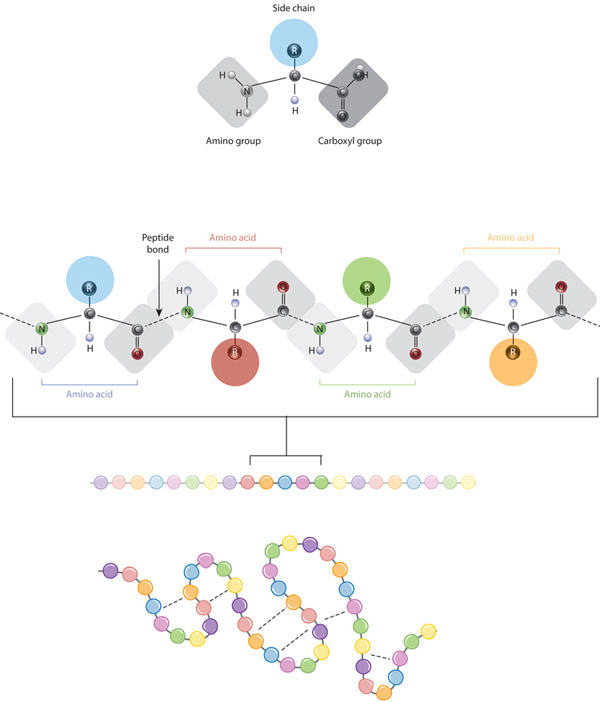
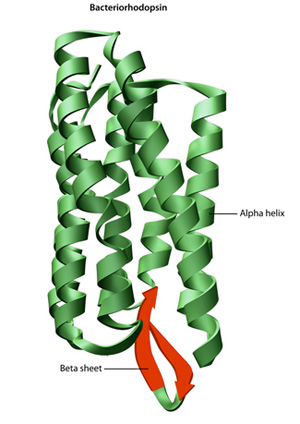
den primära strukturen hos ett protein — dess aminosyrasekvens — Driver vikning och intramolekulär bindning av den linjära aminosyrakedjan, som i slutändan bestämmer proteinets unika tredimensionella form. Vätebindning mellan aminogrupper och karboxylgrupper i angränsande områden av proteinkedjan orsakar ibland vissa mönster av vikning att uppstå., Kallas alpha helices och beta ark, dessa stabila vikningsmönster utgör den sekundära strukturen av ett protein. De flesta proteiner innehåller flera spiraler och ark, förutom andra mindre vanliga mönster (Figur 2). Ensemblet av formationer och veck i en enda linjär kedja av aminosyror — ibland kallad en polypeptid — utgör en tertiär struktur av ett protein. Slutligen hänvisar den kvartära strukturen hos ett protein till de makromolekyler med flera polypeptidkedjor eller subenheter.,
den slutliga formen som antagits av ett nyligen syntetiserat protein är vanligtvis den mest energiskt gynnsamma. Som proteiner viks testar de en mängd olika konformationer innan de når sin slutliga form, vilket är unikt och kompakt. Vikta proteiner stabiliseras av tusentals icke-kovalenta bindningar mellan aminosyror. Dessutom bidrar kemiska krafter mellan ett protein och dess omedelbara miljö till proteinform och stabilitet., Till exempel har proteinerna som löses i cellcytoplasman hydrofila (vattenälskande) kemiska grupper på sina ytor, medan deras hydrofoba (vatten-inversa) element tenderar att vara undangömda inuti. Däremot visar proteinerna som sätts in i cellmembranen vissa hydrofoba kemiska grupper på deras yta, speciellt i de regioner där proteinytan utsätts för membranlipider. Det är dock viktigt att notera att helt vikta proteiner inte fryses i form. Snarare kan atomerna inom dessa proteiner göra små rörelser.,
även om proteiner anses makromolekyler, är de för små för att visualisera, även med ett mikroskop. Så, forskare måste använda indirekta metoder för att räkna ut hur de ser ut och hur de viks. Den vanligaste metoden som används för att studera proteinstrukturer är röntgenkristallografi. Med denna metod placeras fasta kristaller av renat protein i en röntgenstråle, och mönstret av avböjda röntgenstrålar används för att förutsäga positionerna för tusentals atomer inom proteinkristallen.















